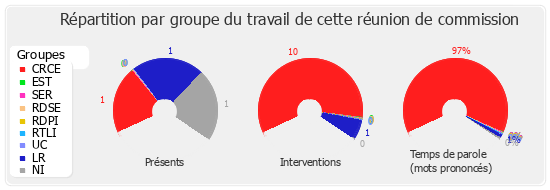
Mission commune d'information sur le Mediator
Réunion du 17 février 2011 : 1ère réunion
Sommaire
- Audition de m. bruno toussaint directeur de la revue « prescrire » (voir le dossier)
- Audition de m. dominique martin directeur de l'office national d'indemnisation des accidents médicaux oniam (voir le dossier)
- Audition de m. andré wencker directeur général de la mutuelle générale des cheminots (voir le dossier)
- Audition de m. le professeur pierre-louis druais président du collège de médecine générale (voir le dossier)
La réunion

L'audition étant publique, je dois vous demander, en application de l'article L. 4113-13 du code de la santé publique, de nous faire connaître, si vous en avez, vos liens avec des entreprises produisant ou exploitant des produits de santé ou avec des organismes de conseil intervenant sur les produits concernés.
Comme tout rédacteur de Prescrire, je n'ai aucun lien d'intérêt avec aucune firme du domaine de la santé.

Merci. Je vous laisse à présent la parole pour une intervention liminaire avant que Mme le rapporteur et nos collègues ne vous posent un certain nombre de questions.
Le fait que la séance soit publique est extrêmement important pour répondre aux questions qui se posent. En effet, un des éléments du drame du Mediator, qui a fait des milliers de victimes (personnes handicapées ou mortes), réside dans le secret, dans la rétention d'information. Il apparaît donc extrêmement important qu'en antidote, l'ensemble des personnes intéressées bénéficient d'une grande transparence et d'une information satisfaisante.
Selon nous, le dossier du Mediator n'est pas un cas isolé ou une « histoire française » mais le révélateur d'un ensemble de dysfonctionnements graves du système d'administration des médicaments, s'agissant tant de l'autorisation de mise sur le marché et de la surveillance que des procédures de retrait du marché. Les procédures et les dysfonctionnements n'ont en l'occurrence rien de spécifiquement français. Les règles du jeu sont en effet identiques, avec quelques nuances, dans l'ensemble des pays européens et du reste du monde. Il apparaît par conséquent extrêmement important que la lumière soit faite sur le dossier du Mediator. Il est effectivement essentiel d'en tirer un grand nombre de leçons pour modifier un grand nombre de paramètres en France et dans le reste du monde.
Je préfère à présent répondre à vos questions.

Quels sont les dysfonctionnements constatés aujourd'hui sur le marché en matière d'autorisation et de retrait au niveau français, au niveau européen et au niveau mondial ? Existe-t-il notamment, selon vous, une différence entre les dysfonctionnements constatés dans le recours au Vioxx, pour lequel le Sénat et l'Assemblée nationale avaient conduit une mission d'information, et le cas du Mediator ? Autrement dit, dans le cadre de chaque retrait d'un médicament, le Sénat, l'Assemblée nationale, etc., seront-ils amenés à conduire une mission d'information ? Existe-t-il des dysfonctionnements récurrents en l'occurrence qui devraient rapidement être corrigés ?
Les difficultés sont identiques partout, avec seulement quelques nuances. Le désastre du Vioxx est simplement apparu comme davantage américain. Il s'agit en effet d'un médicament américain, tandis que les seules statistiques sérieuses disponibles sur les victimes ont été américaines. En France, nous n'avons presque rien su. Il n'en demeure pas moins que les ingrédients sont identiques. L'ensemble des dysfonctionnements mis à jour après le scandale du Vioxx, y compris dans le cadre de la mission d'enquête sénatoriale, sont ainsi toujours à l'oeuvre. Aucune des préconisations de l'époque n'a effectivement été mise en oeuvre. Les conditions n'ont pas changé. Si rien ne change à présent, nous subirons d'autres désastres de grande ampleur. Il s'agit d'une évidence.
Si nous considérons la liste, qui est déjà connue, nous pouvons constater que l'autorisation de mise sur le marché (AMM) est accordée selon un dossier monté par la firme elle-même. La firme pharmaceutique est par conséquent placée dans un conflit d'intérêts massif puisque les pouvoirs publics lui demandent d'évaluer elle-même le médicament dont elle sollicite l'autorisation de mise sur le marché pour gagner de l'argent. Il conviendrait en réalité que la recherche sur le médicament, en particulier la recherche clinique, ne soit plus financée majoritairement par l'industrie pharmaceutique. Ensuite, en ce qui concerne les critères d'obtention de l'AMM, aussi longtemps que des preuves de progrès thérapeutique apportées par le nouveau médicament par rapport aux moyens déjà à disposition ne sont pas exigées, nous serons confrontés à des médicaments qui font courir des risques injustifiés aux patients. Dans le système actuel, une firme peut en effet obtenir une autorisation de mise sur le marché pour un médicament qui n'apporte aucun progrès par rapport à l'existant. Parallèlement, il existe un nombre suffisant de moyens de communication pour convaincre un grand nombre de prescripteurs de prescrire le médicament. L'affaire est donc rentable sans dégager le moindre progrès. Bien entendu, eu égard aux incertitudes qui entourent les effets indésirables dans le dossier d'AMM (qui ne porte que sur quelques centaines de patients), dès lors que le médicament est largement distribué dans la population, de nouveaux effets indésirables sont découverts, parfois extrêmement graves.
Le système actuel d'AMM, en France et ailleurs, est en définitive trop perméable à des médicaments qui n'apportent aucun progrès voire qui représentent une régression thérapeutique. Malgré tout, les firmes pharmaceutiques disposent d'un nombre suffisant de moyens de promotion pour gagner de l'argent avec de tels médicaments. Le système perdure ; la population reste ainsi exposée à un trop grand nombre de médicaments plus dangereux qu'utiles.

Parlons concrètement. Une liste de soixante-dix-sept médicaments sous surveillance vient d'être publiée, parmi lesquels le Levothyrox. Certains médecins affirment cependant que le retrait des prescriptions de Levothyrox pourrait engendrer des difficultés thyroïdiennes conséquentes chez les patients qui l'utilisent. Quels commentaires pouvez-vous apporter dans le domaine ?

Si vous me le permettez, madame, j'ajouterai une question. Parmi les soixante-dix-sept médicaments dont il est question, vingt-cinq médicaments ont une ASMR 5 (amélioration du service médical rendu). N'est-il pas plus simple dès lors de retirer du marché les médicaments concernés, qui non seulement sont inutiles mais sont également dangereux puisqu'ils bénéficient d'une surveillance particulière ?
La liste des soixante-dix-sept médicaments sous surveillance est particulièrement confuse. Elle a fait naître un grand nombre d'angoisses. Elle pourrait se révéler désastreuse. Son unique avantage réside dans le fait qu'elle permet d'aborder le sujet à grande échelle puisqu'un grand nombre de personnes se sentent désormais concernées.
Pour répondre à vos questions, le Levothyrox est le nom commercial du produit. La substance active est la lévothyroxine. Il s'agit de l'hormone humaine produite par la thyroïde. Elle est indispensable à des personnes dont la thyroïde est devenue inefficace en raison de telle ou telle maladie. Le médicament est donc essentiel. Il est connu depuis des décennies. Sa présence sur la liste n'est à cet égard motivée que par certains de ses génériques, signalés pour leur inefficacité. Le sujet n'est donc ni la surveillance de la lévothyroxine, qui est très bien connue, ni la surveillance du Levothyrox, mais l'absence de qualité de certains génériques. Il s'agit d'un problème particulier qui n'a aucun rapport avec le Mediator. Il est choquant à cet égard de voir le Levothyrox mis sous surveillance.
Par ailleurs, rappelons que le niveau 5 de l'ASMR sous-tend précisément l'absence d'amélioration du service médical rendu. Les médicaments qui présentent une ASMR de niveau 5 n'apportent a priori aucun progrès par rapport à l'existant. Nous sommes donc en droit d'être particulièrement exigeants vis-à-vis des effets indésirables des médicaments concernés. Leurs effets indésirables devraient suffire en l'occurrence à les évincer du marché. Pour autant, les médicaments concernés sont inutiles dans le sens où ils font double emploi. Doivent-ils être retirés ? Je n'ai pour ma part pas analysé la liste sous cet angle. Je ne peux donc aller aussi loin.

Vous affirmez que lorsqu'un médicament est mis sur le marché, il existe un obstacle particulier dans le fait que la recherche clinique est financée par l'industrie pharmaceutique. Dans le cadre de la mission que nous avons conduite sur le Vioxx, il nous avait été précisé que lorsqu'un médicament est mis sur le marché, il l'est selon un modèle pasteurien, appliqué à une population qui souffre d'une pathologie chronique. N'existe-t-il pas par conséquent un dysfonctionnement entre la norme qui permet au médicament d'être présent sur le marché et la population qui prendra le médicament ? Le problème en l'occurrence ne relèverait pas du financement mais de la norme et du modèle.
Dans le système actuel, les firmes pharmaceutiques sont incitées à conquérir des parts de marché plus larges, d'un marché qui sera chronique et qui concernera un grand nombre de personnes. Je veux signifier ainsi que l'intérêt des firmes pharmaceutiques consiste actuellement à vendre le plus grand nombre de médicaments, le plus longtemps possible, au plus grand nombre de personnes possible. Avec un tel modèle, un grand nombre de firmes accomplissent des efforts pour conquérir des parts de marché sur lesquelles elles ne prétendent pas guérir avec les médicaments qu'elles proposent, par exemple pour le diabète de type 2 : aucun des médicaments actuels, dont certains sont controversés, ne guérit du diabète. Il est nécessaire de les prendre indéfiniment pour espérer prévenir une partie des complications. Les recherches ne portent plus par conséquent sur des médicaments qui visent à guérir un certain nombre de problèmes (par exemple sur les anti-infectieux). Vioxx est notamment un anti-inflammatoire qui ne guérit rien. Ses promoteurs n'ont aucune prétention à guérir d'une quelconque maladie. Il s'agit d'un médicament symptomatique qui vise les rhumatismes chroniques. Les anti-inflammatoires ne guérissent pas dans le domaine. Ils diminuent en partie les symptômes pour une partie des patients. L'arrêt des médicaments entraîne ainsi un retour en arrière, même si la maladie a ses fluctuations. Je crois par conséquent que nous ne devons pas croire que la recherche actuelle porte sur des médicaments qui viseraient à guérir les maladies. Les firmes, au contraire, se sont entêtées à gagner des parts de marché sur des maladies chroniques qu'elles ne guérissent pas.

Dès le mois de mai 1997, vous avez publié un certain nombre d'articles sur le Mediator. A quelle date le médicament aurait-il dû être retiré de la vente ? Avez-vous, en outre, écrit des articles sur d'autres médicaments dont personne ne se soucie aujourd'hui mais qui pourraient être retirés de la vente ?
Il convient de se montrer exigeant avec les médicaments, de réaliser un tri pour conserver ceux d'entre eux qui rendent des services importants et d'éliminer les médicaments de second ordre qui sont plus dangereux qu'utiles. Ils sont nombreux dans les pharmacies familiales, dans les officines, dans les pharmacies d'hôpitaux, dans les traités de médecine, dans les périodiques d'information, dans le cerveau des médecins, des pharmaciens et des infirmiers, etc. Il est nécessaire de se concentrer sur les médicaments importants et les progrès réels. Depuis trente ans, une des rubriques de Prescrire baptisée « Rayon des nouveautés » a précisément pour objectif de réaliser un tri parmi les nouveaux médicaments.
La question de l'intérêt d'un médicament et de sa mise sur le marché se pose toujours dans une situation précise. L'aspirine, en sa qualité d'antiagrégant plaquettaire, à petites doses pour limiter le risque de thrombose, artérielle en particulier après un infarctus du myocarde, représente un médicament extrêmement utile. En revanche, à titre de médicament contre la fièvre ou contre les douleurs, l'aspirine est dépassée. Il n'existe en l'occurrence aucune raison d'utiliser l'aspirine aujourd'hui dans ce domaine.
S'agissant de votre question précédente, nous avons effectivement publié deux textes, en 1997, d'analyse approfondie de la balance bénéfice-risque concernant le Mediator. Nous avons constaté l'absence de preuve de l'efficacité tangible du médicament. Dans la catégorie des bénéfices, aucun élément probant ne venait ainsi s'inscrire autre qu'un effet placebo. A l'inverse, en matière de risques, le Mediator étant un coupe-faim, il nous est apparu que les effets indésirables liés à ce type de produit ne tarderaient pas à se faire jour, même si, à l'époque, nous n'avons trouvé qu'un faible nombre de données dans le domaine. Nous avons écrit par conséquent qu'il n'existait aucune raison de se servir de ce médicament et qu'il y avait lieu de revoir sa présence sur le marché et sa prise en charge par l'assurance maladie. A notre avis, à l'évidence, en 1997, le médicament aurait dû ainsi être retiré du marché. L'administration belge avait même étudié le dossier en 1977 pour parvenir à des conclusions identiques.
Il existe sans aucun doute des situations analogues pour d'autres médicaments. Chaque année, quelques nouveaux médicaments nous apparaissent ainsi plus dangereux qu'utiles. Ils n'apportent pas des progrès mais des régressions thérapeutiques. Nous n'en tenons pas cependant une liste précise. Nous apportons simplement l'information sur le sujet au fil des mois et des années aux professionnels de santé. Il leur appartient ensuite d'utiliser les informations concernées pour adapter leurs décisions en les partageant avec les patients. L'aspect désastreux de la liste des soixante-dix-sept médicaments dont nous parlions précédemment réside dans le fait qu'elle ne présente aucune piste pour permettre une réflexion avec le patient. Quoi qu'il en soit, depuis 2005, la liste des médicaments qui n'apportent aucun progrès thérapeutique est passée de quelques unités à une quinzaine chaque année. A l'inverse, les sorties du marché pour effets indésirables sont au nombre de trois ou quatre chaque année. Il en entre ainsi davantage qu'il n'en sort sur le marché. Je ne peux néanmoins pas dresser une liste nominative précise. J'indique simplement qu'un certain nombre d'aspects doivent être modifiés dans les conditions d'autorisation de mise sur le marché et de surveillance des médicaments sous peine de voir le cas du Mediator se renouveler en France et partout dans le monde.

Quel est le rôle de la presse médicale en matière de formation des médecins ? Quels sont les moyens qui permettraient de renforcer son indépendance ? Estimez-vous en outre que la charte de la visite médicale représente un outil efficace ? Préconisez-vous des mesures complémentaires en la matière ?
Les professionnels de santé ont besoin d'une information indépendante sur les thérapeutiques en général, les médicaments en particulier. La presse biomédicale est majoritairement financée par des firmes pharmaceutiques sous forme de publicité. Dès lors, les supports sont sous influence. La revue Prescrire est au contraire financée exclusivement par les abonnements. Elle n'insère dans ses pages aucune publicité. Elle ne bénéficie d'aucune subvention. Elle n'a pas d'actionnaires puisque l'éditeur est une association à but non lucratif selon la loi de 1901. Il est ainsi possible de disposer d'une presse indépendante des firmes de santé financée par ses abonnés, même si elle est plus coûteuse à l'abonnement que les concurrents financés par les firmes pharmaceutiques.
La situation est identique dans tous les pays. Il existe dans chaque pays au moins une équipe indépendante des firmes pharmaceutiques qui diffuse une information indépendante, fiable et critique sur les médicaments. La plupart des équipes concernées sont regroupées au sein d'un réseau international dont fait partie la revue Prescrire.
Par ailleurs, il n'existe pas d'information fiable à attendre des visiteurs médicaux. Ils sont en effet rémunérés par une firme pharmaceutique ou un prestataire de service et jugés sur les chiffres de vente. Ils sont donc directement intéressés aux ventes des médicaments du moment qu'ils doivent promouvoir. Les chartes et autres encadrements ne changeront rien au problème, qui est celui du financement même et du critère de jugement de performance de la profession. La solution réside simplement dans le fait que médecins et pharmaciens réalisent qu'ils n'ont pas d'informations fiables à attendre des visites médicales. Ils doivent par conséquent cesser de recevoir les visiteurs médicaux ou pharmaceutiques. Ils sont d'ailleurs de plus en plus nombreux dans ce cas.
Le media humain, c'est-à-dire un visiteur qui vient apporter une information sur un médicament au professionnel de santé, peut représenter cependant une avancée. Ainsi, dans certains pays, et selon plusieurs expériences menées en France, le visiteur n'était pas rémunéré par les firmes pharmaceutiques mais par un organisme d'intérêt public. L'information ne servait pas en l'occurrence à promouvoir les ventes mais la qualité des prescriptions. Le visiteur constitue dès lors un outil efficace.

A quel exemple faites-vous référence en France ? A ma connaissance, il existe en effet les délégués de l'assurance maladie rémunérés par l'assurance maladie. Il n'existe pas en revanche de visiteurs médicaux rémunérés par une instance indépendante de la sécurité sociale et des laboratoires.
Vous avez raison. En Belgique, en revanche, il existe à ma connaissance un réseau de visiteurs indépendants de l'assurance maladie. Je ne connais pas cependant le détail du financement du dispositif.
Le dispositif est plus appréciable que celui d'un financement par une firme pharmaceutique. Cela étant, l'assurance maladie doit également assurer une performance économique. Le modèle économique recommandé par Prescrire consiste au contraire en un financement par les personnes intéressées (principalement les professionnels de santé mais également les patients). Ce modèle permet en effet la plus grande indépendance.

Le niveau de financement de l'Afssaps vous paraît-il aujourd'hui satisfaisant ? Quelles mesures concrètes préconisez-vous en termes de gouvernance pour améliorer le système au-delà de la problématique du financement ?
A notre avis, le financement d'une agence du médicament doit être indépendant des firmes. Le moindre lien avec les redevances (les frais de dossier) est néfaste. Il ne doit exister aucun rapport financier entre les firmes et l'agence. Le plus grave, selon nous, est le fait que les décisions des agences sont sous influence des firmes. En regard des décisions prises, nous nous sommes ainsi interrogés en 2005 pour savoir si l'Afssaps travaillait dans l'intérêt des firmes ou dans l'intérêt des patients. Trop souvent dans les décisions prises ou proposées par l'Afssaps, en effet, l'intérêt économique des firmes pharmaceutiques prévaut. Nous le voyons avec l'affaire du Mediator. Trop souvent, l'Afssaps est sensible à l'argumentation des firmes jusqu'à considérer que des études supplémentaires doivent être avancées pour prouver que le médicament est dangereux. Pendant le délai, les patients restent exposés, les effets indésirables surviennent, le nombre de victimes augmente mais les ventes se poursuivent. Le financement n'est pas le seul facteur déterminant de la situation. J'invoquerai pour ma part comme solution un état d'esprit général qui doit s'instaurer considérant constamment comme prioritaire le fait que la mission des personnes qui travaillent à l'Afssaps réside en premier lieu dans la protection de la population et non dans la régulation du marché. Le point est d'autant plus choquant que l'agence française dans le domaine est baptisée Agence française de sécurité sanitaire des produits de santé. Où est la sécurité sanitaire pourtant lorsque le Mediator est laissé plusieurs années sur le marché ?
Le point recoupe la question du financement de la recherche clinique. Aussi longtemps que la recherche clinique sera financée par les firmes pharmaceutiques, il est évident que les firmes pharmaceutiques sont conduites à contacter et à utiliser les services de nombreux cliniciens, de nombreux spécialistes, de nombreux connaisseurs de telle ou telle maladie. Un cercle vicieux se met en place puisque davantage d'experts ont des liens d'intérêts avec les firmes pharmaceutiques. Il est indispensable de s'attaquer à la situation.

Vous nous avez indiqué disposer de 30 000 abonnements. Le chiffre est faible en regard du nombre de prescripteurs présents en France. Par quels autres moyens, dès lors, une alerte peut-elle être donnée auprès du corps médical ? Comment votre rôle peut-il en l'occurrence être démultiplié ?
Un quart des médecins généralistes français et 5 000 à 6 000 pharmaciens (pour 20 000 officines) sont abonnés actuellement à la revue Prescrire. Il s'agit certes d'une minorité. Elle augmente cependant à l'heure actuelle car l'affaire du Mediator ouvre les yeux à un grand nombre de personnes, qui réalisent qu'une grande partie de l'information du médicament est entre les mains des firmes pharmaceutiques.
D'où l'alerte peut-elle venir ? Elle devrait venir selon nous des agences du médicament. Les agences du médicament devraient être en priorité au service de la protection de la santé des personnes. Les agences du médicament diffusent certes une certaine information. Sur le site de l'Agence européenne du médicament, par exemple, des rapports d'évaluation sont accessibles. Tel n'était pas le cas jusqu'aux années 1990. Les progrès restent lents cependant. Ils nécessitent d'être encouragés. A notre avis, l'information doit davantage venir en effet des agences du médicament. Les avis de la commission de la transparence sont également intéressants. Ils sont accessibles en ligne. Il est possible parfois de critiquer la lenteur de la mise en ligne. Il convient en outre de garder à l'esprit que des conflits d'intérêt sont également à l'oeuvre. Malgré tout, l'information est plus intéressante que celle qu'apportent les visiteurs médicaux, la publicité ou les relais d'opinion plus ou moins clairement financés par l'industrie pharmaceutique. Il existe enfin d'autres sources d'information hors de France (périodiques, sites d'information belges notamment, la maîtrise de l'anglais biomédical permettant en outre de bénéficier d'un grand nombre d'informations, même si l'information de qualité est payante).

Environ 50 % des prescriptions médicamenteuses s'effectuent hors AMM. Qu'en pensez-vous ?
Le statut de médicament est le statut le moins mauvais des produits de santé. Il est clair que le statut de médicament avec autorisation de mise sur le marché est plus favorable que le statut de complément alimentaire ou de dispositif médical. C'est pourquoi nous devons nous montrer extrêmement exigeants quant à l'AMM. Prescrire concentre d'ailleurs la majorité de ses moyens sur les médicaments avec AMM. Cela étant, il convient de ne pas confondre AMM et état de la science. L'AMM est une autorisation en réponse à la demande d'une firme pharmaceutique qui souhaite avoir une part de marché pour une situation clinique précise, pour un problème de santé précis, pour un patient précis. Le champ est donc extrêmement étroit par rapport à l'ensemble des problèmes de santé à traiter. Il est logique par conséquent qu'il existe des prescriptions hors AMM. La difficulté consiste à savoir si les prescriptions hors AMM sont conformes aux données de la science. Prescrire n'étudie pas méthodiquement l'ensemble des prescriptions hors AMM. Le champ est en effet immense et difficile à analyser. En revanche, Prescrire analyse et compare les choix thérapeutiques du point de vue de l'évaluation comparative entre bénéfices et risques des divers traitements qui existent pour faire face à un problème de santé. Si les données montrent que le meilleur médicament n'est pas autorisé en France, nous incitons les abonnés à examiner cette possibilité avec attention. Il est probable que le médicament est ensuite utilisé par certains patients. Nous incitons donc parfois à prescrire hors AMM. Le cas n'est pas fréquent car souvent, la prescription hors AMM ne correspond pas à une bonne évaluation comparative de la balance bénéfice-risque et du progrès par rapport aux médicaments existants. La situation peut cependant se produire.

Quelles sont les ressources humaines et les méthodes de l'équipe de Prescrire ?
L'équipe compte une centaine de personnes, correspondant à environ soixante-dix équivalents temps plein (ETP). Nous cherchons à disposer d'une certaine indépendance financière et donc intellectuelle par l'abonnement. La méthode de travail est collective. Les rédacteurs s'engagent préalablement à ne pas entretenir de liens avec les firmes pharmaceutiques ou le domaine de la santé plus généralement. Les articles sont signés Prescrire et non nominativement. Chaque texte comporte un rédacteur principal. Il est cependant entouré d'une équipe qui décide des priorités du moment selon les rubriques. Lorsque nous avons décidé de réaliser un article sur un sujet précis, nous recherchons un rédacteur compétent à cette fin. Il s'agit du rédacteur référent, entouré toutefois d'une équipe. Le responsable de rubrique passera ensuite l'ensemble du dossier en revue. Le responsable de rubrique propose le texte à un comité de lecture d'une vingtaine ou d'une trentaine de personnes (à l'intérieur comme à l'extérieur de Prescrire pour croiser un certain nombre de points de vue) dont des médecins généralistes, des pharmaciens, etc., pour recouper un grand nombre de points de vue. L'ensemble du dossier est de nouveau confié au rédacteur principal, qui est chargé d'examiner les contributions des relecteurs. Il ne cherche pas alors une synthèse consensuelle mais un texte informatif. Le responsable de rubrique passe ensuite de nouveau en revue l'ensemble du dossier, y compris les contributions des relecteurs et la façon dont le rédacteur les a prises en compte. Le rédacteur adjoint compare ligne à ligne la véracité des assertions du texte avec les références retenues. Pour les nouveaux médicaments, nous interrogeons en outre méthodiquement selon un protocole précis la firme pharmaceutique concernée, l'agence du médicament, la littérature scientifique et les autres équipes indépendantes.

Vous avez précisé qu'en 1997, vous aviez analysé le Mediator. Vous aviez alors démontré l'absence de preuve d'efficacité. Y avez-vous consacré les gros titres de votre revue pour alerter vos lecteurs sur le sujet ? Des retombées de la part des firmes pharmaceutiques ont-elles été constatées ? Comment, plus généralement, votre revue est-elle considérée par les firmes pharmaceutiques et par l'ensemble des organismes nationaux ? Enfin, votre revue est-elle accessible aux béotiens qui ne connaissent pas la médecine ?

Je souhaite compléter vos questions. Les 30 000 abonnements à Prescrire sont-ils payants ? Quelle est l'ampleur de la diffusion gratuite ?
Nous n'avons pas consacré nos gros titres au médicament. Les articles représentaient trois pages. Rétrospectivement, nous pouvons le regretter. Cependant, un grand nombre de difficultés se posent dans le domaine de la santé ; nous ne pouvons donc consacrer des gros titres à chaque sujet. Nous apportons simplement une information. Nous ne cherchons pas le sensationnel. En outre, à l'époque, il n'existait pas de preuve concrète des effets indésirables. Nous pointions pour notre part son inutilité et les très forts doutes sur ses effets indésirables. A l'époque, dans la rubrique Vigilance, des dossiers plus urgents que ce dossier ont probablement été traités.
La revue Prescrire par ailleurs est accessible uniquement sur abonnement. Il s'agit du seul modèle économique qui a paru fiable à l'équipe et qui est efficace. La revue est née dans les années soixante-dix grâce à une subvention du ministère de la santé avant que l'équipe ne décide de s'en passer pour vivre des abonnements. Chacun en outre est rémunéré chez Prescrire correctement.
L'essentiel des abonnés et des rédacteurs sont des professionnels de santé. Il est donc exact que la lecture de la revue demande un pré-requis de culture médicale. Cependant, l'expérience montre que l'intérêt pour un sujet facilite la possibilité de se cultiver dans le domaine, rendant ainsi plus intelligibles les textes de Prescrire.

J'apporterai pour ma part une réponse sur la réputation que vous avez auprès des firmes. Ainsi, M. Lajoux vous considère comme une « milice privée ».
Les firmes pharmaceutiques ne sont pas à considérer globalement. Prescrire organise par exemple chaque année au mois de janvier « La pilule d'or », et trois palmarès des nouveaux médicaments. Nous récompensons des firmes pharmaceutiques qui, à notre avis, ont travaillé de manière satisfaisante. Les représentants des firmes pharmaceutiques nominées par Prescrire sont heureux de venir à notre manifestation. Ils sont venus cette année chercher un diplôme par lequel Prescrire salue leur travail. Prescrire, en tout état de cause, n'est pas hostile aux firmes pharmaceutiques. Prescrire est favorable aux firmes pharmaceutiques qui accomplissent un travail approprié qui permet de mieux soigner. Quand une firme met sur le marché un médicament qui apporte un progrès, nous la saluons. Quand une firme met sur le marché un médicament qui constitue une régression thérapeutique, nous ne la saluons pas.

Pour conclure, je souhaite vous poser deux questions. La première concerne l'expertise. Vous semble-t-il que la présence d'experts dans les commissions de l'Afssaps ayant des liens d'intérêts, bien que les liens d'intérêts fassent l'objet de mesures de transparence, est compatible avec la mission qui leur est dévolue ? Est-il possible en l'occurrence d'être à la fois conseiller des firmes et conseiller des pouvoirs publics ?
Il existe plusieurs études dans le cadre desquelles les médecins ont été interrogés sur l'influence de la visite médicale. Fréquemment, la réponse majoritaire consiste à affirmer que les autres personnes sont influencées tandis que l'individu interrogé sait garder son esprit critique. L'expérience montre en l'occurrence que la visite médicale auprès des prescripteurs est efficace pour augmenter les ventes. A notre avis, les experts ne doivent pas par conséquent avoir de lien d'intérêts avec les firmes pharmaceutiques.

La seconde question concerne le circuit du médicament. Comme vous le savez, il est extrêmement complexe. Préconisez-vous des réformes ? Dans quel sens iraient les réformes que vous préconiseriez ? Quelle place, en particulier, la pharmacovigilance doit-elle tenir dans le système ? Qu'en est-il de la fixation du prix ?
Il est important que les moyens financiers et humains de la pharmacovigilance en France soient augmentés. En France comme dans d'autres pays, la pharmacovigilance est en effet sous-développée. Je parle évidemment de la pharmacovigilance à financements publics. Les préconisations des instances de pharmacovigilance doivent notamment avoir autant de poids que les préconisations des commissions d'AMM. La situation actuelle doit donc être modifiée puisque la commission de la pharmacovigilance doit toujours en référer à la commission d'AMM. Nous devons trouver un meilleur équilibre. L'équilibre est également le mot-clé du nouveau système à mettre en place s'agissant des rapports de force avec les firmes pharmaceutiques, qui sont omniprésentes dans le système. Par exemple, le budget de fonctionnement de l'Agence du médicament est de l'ordre de 100 millions d'euros chaque année. Le chiffre d'affaires de la firme Servier est quant à lui de l'ordre de 3 milliards d'euros. Il existe ainsi une énorme disproportion de moyens qui rend les firmes pharmaceutiques omniprésentes dans le domaine de la santé. Les firmes pharmaceutiques financent la recherche clinique, un grand nombre d'experts, une partie de la formation des professionnels de santé, une bonne partie des associations de patients, etc. Il est nécessaire à cet égard de rééquilibrer les rapports entre les acteurs de la santé, en remettant notamment les firmes pharmaceutiques à leur place.

Votre revue s'est-elle parfois trompée dans ses analyses ? Si tel a été le cas, en avez-vous informé vos lecteurs ?
Nous avons deux rubriques régulières dans le domaine. La première est baptisée Précisions, corrections. Nous y corrigeons les coquilles et les erreurs factuelles que nous avons commises. La seconde est baptisée Prescrire en questions. Nous y publions les contestations écrites que nous adressent les firmes pharmaceutiques. La lettre que nous avait adressée le directeur de l'Afssaps y a été publiée, ainsi que notre réponse.
Sincèrement, je ne crois pas que nous nous soyons trompés fréquemment. Nous avons notamment révisé notre jugement sur un médicament orphelin. Au vu des données, nous avons en effet considéré initialement que le médicament apportait beaucoup. Ensuite, avec d'autres données, nous avons constaté que le progrès était moins important que prévu. Nous avons donc publié une seconde analyse.

Vous parliez précédemment du choix laissé au patient. Le patient cependant parfois, en regard de la douleur qu'il endure, ne sait pas quelle décision prendre. Il sera peut-être porté vers le choix d'utiliser un médicament aux effets indésirables mais qui le soulagera.
Bien sûr. Pour un grand nombre de problèmes de santé, la décision est difficile à prendre. Les patients ont dès lors intérêt à utiliser la prestation de service d'un professionnel de santé. C'est pourquoi Prescrire tâche de diffuser une information qui permette de prendre des décisions sur une base solide. Le sujet mérite beaucoup d'énergie.

L'audition étant publique, je dois vous demander, en application de l'article L. 4113-13 du code de la santé publique, de nous faire connaître, si vous en avez, vos liens avec des entreprises produisant ou exploitant des produits de santé ou avec des organismes de conseil intervenant sur les produits concernés.

Je n'ai aucun lien avec des entreprises produisant ou exploitant des produits de santé ou avec des organismes de conseil intervenant sur les produits concernés.

Mon intervention portera sur la réparation du dommage corporel causé par le Mediator. Je vous propose par conséquent de dresser un panorama des différentes possibilités qui existent dans le domaine de la réparation.
En cas d'accident médical, il existe en premier lieu la possibilité d'un règlement amiable direct avec le responsable et son assureur. Je ne crois pas qu'en l'occurrence, le point soit opportun et facile. Ensuite, il existe le régime de droit commun, c'est-à-dire le recours au juge. Je citerai les procédures pénales comme les procédures civiles. Un peu moins d'une dizaine de procédures civiles sont actuellement en cours. Dans certaines procédures civiles, l'Oniam a été appelé en tant que partie. Dans ce système, le délai apparaît plus rapide que le recours au pénal. Les personnes peuvent en effet obtenir dans un délai raisonnable d'une année un référé avant d'amener l'affaire au fond. Par ailleurs, il existe depuis la loi de 2002 les commissions régionales de conciliation et d'indemnisation et l'Oniam, c'est-à-dire un dispositif public et amiable des accidents médicaux. La particularité du système réside cependant dans le fait qu'il n'est accessible qu'aux personnes victimes d'un accident postérieur au 4 septembre 2001. Les prescriptions doivent donc être postérieures au 4 septembre 2001. D'autre part, il existe des conditions d'accessibilité liées à un seuil de gravité fixé par décret. L'incapacité permanente doit ainsi être de l'ordre de 25 % (niveau relativement élevé). Le dispositif présente des avantages : il est rapide et gratuit. Si la commission saisie par la personne s'estime compétente, elle diligente une expertise au fond. La commission se réunit ensuite dans son ensemble pour émettre un avis transmis au responsable et à son assureur. Quand l'assureur n'adresse pas d'offre à la victime, celle-ci peut demander à l'Oniam de se substituer au responsable et à son assureur. L'Oniam adresse une offre à la victime. Il est ensuite subrogé dans les droits de la personne et se retourne contre l'acteur de santé en cause devant le juge. La victime a ainsi reçu réparation dans un court délai. Le dispositif, avec 4 000 dossiers chaque année, est cependant à saturation à ce jour.
Par ailleurs, l'Oniam gère des missions plus particulières. Il a hérité en propre en effet de missions qui ne passent pas par les commissions régionales de conciliation et d'indemnisation. L'Oniam est ainsi aujourd'hui l'organisme du ministère de la santé qui indemnise un certain nombre de situations (les éventuelles victimes de mesures sanitaires d'urgence notamment). En outre, l'Oniam intervient dans un grand nombre de contentieux (2 000 contentieux civils et un contentieux pénal, celui de l'hormone de croissance). Dans la plupart des cas, dès lors qu'un problème nouveau survient induisant une nouvelle pathologie, le législateur doit intervenir de nouveau pour missionner l'Oniam.
A ces dispositifs, il convient d'ajouter les comités de suivi et d'indemnisation. Le modèle a été créé par la chancellerie à l'occasion de l'accident de Furiani. Il s'agit de traiter les accidents collectifs. Le modèle a été de nouveau utilisé dans de nombreuses circonstances (accidents aériens, AZF, etc.). En cas d'accident collectif, l'ensemble des personnes concernées se réunissent de manière contractuelle (associations de victimes, représentants des caisses, représentants de l'Etat, représentants des assureurs, etc.). L'idée est de déterminer un payeur qui interviendra pour le compte de qui il appartiendra. Le dispositif a récemment été utilisé dans le domaine de la santé, une première fois à Epinal, une seconde fois à Toulouse, dans les deux accidents de sur-irradiation. Le comité d'Epinal a fonctionné de manière extrêmement satisfaisante. A ce jour, quatre cents personnes environ ont été indemnisées. L'assureur a en l'occurrence accepté de payer pour le compte de qui il appartiendra. A Toulouse, le processus est en cours. AXA intervient pour le compte de qui il appartiendra. Le comité de suivi représente une formule appropriée. Il présente cependant des inconvénients. Le dispositif fonctionne notamment de manière satisfaisante dans un cadre géographique limité. Dans une dimension nationale, la situation est plus complexe.
Evidemment, il est possible d'ajouter ce qui serait un modèle ad hoc. Rien n'empêche en effet de créer un modèle spécifique. Je crois avoir lu que Servier a émis une proposition à hauteur de 20 millions d'euros. Il envisage peut-être de créer lui-même un fonds selon un modèle mixte.

Vous parliez des commissions régionales de conciliation et d'indemnisation (CRCI). Pensez-vous que la firme Servier accepterait les décisions des commissions régionales de conciliation et d'indemnisation ?

Je le crois peu. Les dossiers connus à ce jour relèvent, en effet, de situations complexes qui montrent que la firme Servier dispose de moyens juridiques pour parvenir à « s'en sortir ». Le système du point de vue du droit et de la responsabilité est en effet incroyablement complexe, puisqu'il comprend un producteur (qui a fait la promotion de son médicament dans des conditions certes discutables), un prescripteur, une personne qui a délivré le produit (le pharmacien) peut-être dans des conditions qui ne sont pas optimales, et un consommateur. Dans certains cas, par exemple, certains consommateurs ont continué à prendre du Mediator après l'interdiction du médicament. Les personnes avaient en effet stocké le médicament, situation qui a résulté soit d'une erreur de délivrance par le pharmacien, soit d'une responsabilité personnelle liée à l'automédication. En l'occurrence, la firme Servier dispose d'arguments solides.
Par exemple, les prescriptions hors AMM ou dans l'AMM impliquent des questions complexes du point de vue de la responsabilité. Les réponses ne sont pas claires. Une prescription hors AMM ne décharge pas en effet le laboratoire de toute responsabilité. Pour les médecins, la question peut entraîner des problèmes disciplinaires et de responsabilité civile. Le pharmacien qui de son côté a délivré cinq ou six boîtes de Mediator peut également avoir une responsabilité. Ne parlons pas de la forme de « trafic » de Mediator entre patients hors du circuit médical qui complexifie encore la situation du point de vue des responsabilités. Pour indemniser rapidement les personnes, il convient de mettre en place un système relativement concentré et suffisamment puissant pour discuter selon un rapport de forces équilibré avec les firmes pharmaceutiques. Dans le cas contraire, il ne sera pas possible de trouver une solution satisfaisante dans l'attente que les responsabilités in fine soient établies. Il s'agit en l'occurrence d'un tout autre sujet.

Je crois comprendre que dès lors qu'un problème nouveau survient induisant une nouvelle pathologie, le législateur doit intervenir de nouveau pour vous missionner.

J'ai proposé pour ma part à l'administration centrale qu'en cas d'accident sériel, l'Oniam bénéficie d'une autorisation d'intervenir donnée par un simple arrêté. Le processus d'intervention s'en trouverait considérablement allégé.

A propos du Mediator, avez-vous déjà reçu des demandes de la part d'associations de défense des victimes ? Quelles sont les spécificités du dossier d'indemnisation selon vous ? En outre, l'Oniam bénéficie d'un observatoire des risques médicaux chargé de recueillir et d'analyser l'ensemble des données relatives aux accidents médicaux, aux infections iatrogènes, aux infections nosocomiales et à leur indemnisation. Quel bilan tirez-vous du fonctionnement de l'observatoire ? A-t-il pu assumer une mission d'alerte auprès des pouvoirs publics ? Quelle place pourrait-il assumer dans un dispositif d'alerte ?

Nous avons reçu à ce jour neuf demandes auprès des CRCI. Pour deux d'entre elles, une expertise a été diligentée. Pour l'une d'entre elles, l'expertise a été réalisée.
En outre, à la question de savoir si le dispositif a relevé un grand nombre d'infections iatrogènes, la réponse est négative.

La situation est inverse. Les infections nosocomiales représentent en effet environ un tiers des dossiers. Les infections iatrogènes liées à des accidents médicamenteux représentent quant à elles seulement de l'ordre de 1 à 2 % des dossiers.

Les infections nosocomiales résultent-elles de pathologies liées à la chirurgie orthopédique ?

Il s'agit des formes les plus sévères. Les infections nosocomiales apparaissent cependant également dans le cadre d'interventions sur l'appareil digestif, d'interventions cardiaques, etc.

Vous êtes-vous interrogé quant à l'absence de demande de réparation face au préjudice que représentent les infections iatrogènes ?

Je suis comme vous dans l'expectative. Je pense pour ma part que les personnes ne perçoivent pas que les accidents médicaux sont des accidents au sens où nous l'entendons par exemple dans le domaine de la chirurgie. Les personnes ont probablement intégré en l'occurrence la dangerosité des produits de santé.
Pour répondre à une précédente question, j'indiquerai que l'observatoire des risques médicaux ne me semble pas adapté. Nous avons dressé un bilan mitigé de son action. Je pense qu'il pourrait être sérieusement amélioré. L'Oniam n'est d'ailleurs pas l'endroit le mieux approprié pour disposer d'un tel observatoire. L'Oniam est en effet l'un des trois fournisseurs de données existants, avec l'AP-HP et les assureurs. Par sa construction, en outre, il n'est pas un donneur d'alerte. En effet, seuls les dossiers clos sont concernés dans le travail qu'il mène, c'est-à-dire des dossiers étudiés plusieurs années après que l'accident a eu lieu. Or, le délai entre l'accident et la clôture du dossier s'étale sur trois à quinze ans. L'observatoire a été créé en réalité non pas dans une visée d'alerte mais dans une visée économique, pour un partage d'informations.

Nous n'avons pas établi de coûts prévisionnels à ce stade. Le coût moyen d'un dossier médical est de l'ordre de 100 000 euros (y compris les créances des organismes sociaux). Nous ne savons pas cependant à ce jour le nombre de dossiers médicaux qui seront ouverts. Je lis les chiffres dans la presse. Si 2 000 décès étaient indemnisés (sachant que les décès sont moins coûteux à indemniser que les personnes vivantes qui ont subi un préjudice lourd, un handicap), en comptant la fourchette basse du coût du dossier soit 60 000 euros, vous avez une idée du coût prévisionnel s'agissant du Mediator. Les calculs restent cependant, à ce jour, extrêmement théoriques.

Pensez-vous enfin que le système de pharmacovigilance pourrait être amélioré ? Le dispositif de l'Oniam existe-t-il en outre dans d'autres pays ?

Sur la première question, je n'ai aucune compétence. En tant que citoyen, cependant, je répondrai par l'affirmative. En outre, l'Oniam est un dispositif presque unique au monde. Il existe un dispositif équivalent simplement en Belgique.

J'ai souhaité auditionner M. André Wencker car il a réalisé une enquête sur l'industrie pharmaceutique qui m'a semblé particulièrement intéressante. J'aimerais qu'il expose devant nous le résumé de cette enquête.
En outre, l'audition étant publique, je dois vous demander, en application de l'article L. 4113-13 du code de la santé publique, de nous faire connaître, si vous en avez, vos liens avec des entreprises produisant ou exploitant des produits de santé ou avec des organismes de conseil intervenant sur les produits concernés. Je crois cependant que la réponse sera négative.
L'enquête a été motivée par mon étonnement lorsque j'ai découvert les résultats de la société Sanofi Aventis publiés l'année dernière. Les résultats de l'année 2009 faisaient en effet état, pour un chiffre d'affaires de 28 milliards d'euros, d'un résultat opérationnel net de 9 milliards d'euros, soit une marge de plus de 30 %. Vous savez que, pour nos mutuelles, le médicament est un poste important. Il représente aujourd'hui plus de 25 % de nos dépenses. Vous savez également que le médicament représente 17 % des dépenses de l'assurance maladie. Les chiffres précédents ont suscité mon interrogation sur, d'un côté, des systèmes d'assurance maladie obligatoires exsangues et, d'un autre côté, des entreprises qui obtiennent 30 milliards de résultat opérationnel net. Je suis parti à la recherche de documents pour savoir si les chiffres précédents sont la marque d'une entreprise ou d'un secteur. Je les ai trouvés sur Internet et dans les comptes publics que présentent les sociétés concernées, qui sont de très grandes sociétés, en général cotées à la bourse américaine. Le formulaire 10-K, en particulier, donne en quelques chiffres synthétiques l'essentiel de l'activité des entreprises.
Nous avons constitué un échantillon de quatorze sociétés (sept sociétés américaines et sept sociétés européennes). L'échantillon représente 295 milliards d'euros de chiffre d'affaires en 2009. Le coût de production des biens représentait 23,4 % du chiffre d'affaires de l'échantillon. Les coûts de recherche et de développement atteignaient 16 % du chiffre d'affaires de l'échantillon. Le poste le plus important était la vente et l'administration générale, qui affichait un taux de 27 %, sans que j'aie pu à ce stade déterminer les éléments qui relevaient des frais généraux et les éléments qui relevaient du marketing. Nous verrons plus loin cependant que la distinction est possible avec d'autres études.
Le système de rémunérations observé représente également une marque du secteur. Ainsi, chez Merck, les dirigeants se partagent 50 millions de dollars. Les rémunérations « à l'américaine » sont donc également la marque du secteur.
Les dirigeants sont nommés par les actionnaires principaux, souvent des fonds de pension. Les fonds de pension demandent aux dirigeants d'obtenir des rendements extrêmement élevés. Si vous consultez le site de l'industrie pharmaceutique Pharmactua, vous constaterez ainsi que, chez Pfizer, le nouveau dirigeant subit une pression considérable de la part des fonds de pension, qui souhaitent que l'action remonte (elle conditionne en effet le niveau des profits). Pfizer s'interroge ainsi aujourd'hui sur la possibilité de licencier, notamment, pour revenir aux niveaux de résultats attendus dans le secteur, de l'ordre de 30 %. Le système, en définitive, est extrêmement concentré sur la performance économique maximale.
Je m'apprêtais, avant de vous répondre, à évoquer l'étude de la DG15 lancée le 15 janvier 2008. Il y est écrit : « En raison d'informations relatives aux médicaments innovants et génériques suggérant que la concurrence pourrait être restreinte et faussée ». La DG15 a conduit son enquête entre janvier 2008 et juillet 2009.
Il s'agit de la Direction générale de la concurrence au sein de la Commission européenne. Elle est en charge de surveiller les pratiques commerciales des entreprises et de veiller à voir appliquer l'un des objectifs de l'Union Européenne, à savoir l'existence d'un marché qui fonctionne de façon régulière selon une concurrence loyale et avec transparence, pour fournir aux consommateurs le meilleur produit au meilleur prix. Nous sommes en l'occurrence au coeur de la préoccupation de l'Union Européenne.

Je crois qu'il serait important de détailler la composition de la DG15, notamment pour savoir si la pensée anglo-saxonne y est majoritaire.
Je ne peux vous répondre. Je sais simplement que la commissaire était Mme Nelly Kroes, qui, lorsque les résultats du rapport ont été publiés, a fait savoir qu'elle était indignée par les observations de la DG15 en matière de pratiques anticoncurrentielles de l'industrie pharmaceutique.
L'enquête conduite entre janvier 2008 et juillet 2009 a concerné quarante-trois laboratoires de médicaments originaux et vingt-sept fabricants de génériques, qui représentaient 80 % du chiffre d'affaires de l'industrie au sein de l'Union Européenne. 219 substances étaient concernées, dont le chiffre d'affaires correspondant représentait 50 % du chiffre d'affaires total de médicaments délivrés sur ordonnance dans l'Union Européenne. A ce stade, les résultats auxquels la Commission est parvenue corroborent nos résultats. Elle les approfondit pour partie. Ainsi, pour les laboratoires de médicaments originaux, 21 % du chiffre d'affaires sont consacrés à la fabrication des produits, 22 % du chiffre d'affaires sont employés en opérations de vente et en promotion, 17 % du chiffre d'affaires sont dédiés aux dépenses de recherche et de développement, dont 15,5 % correspondent à des coûts de recherche en essais cliniques et 1,5 % correspond à des coûts liés à la recherche fondamentale.
Pour le reste, 31 % du chiffre d'affaires correspondent au résultat opérationnel, sachant que chez les « médicaments vedettes » (dont le chiffre d'affaires au plan mondial dépasse 1 milliard de dollars), il n'est pas rare d'atteindre des marges de 80 %, contre 30 % en moyenne.
La Commission s'est d'ailleurs attardée sur un certain nombre des « médicaments vedettes ». Ils représentent ainsi 22 % du chiffre d'affaires de l'industrie. 46 % d'entre eux auront cependant perdu leurs brevets entre 2008 et 2012. Malgré l'allongement des brevets qu'elle a obtenu avec effet en 2005, généralisable jusqu'en 2013, l'industrie pharmaceutique est par conséquent confrontée à une perte des brevets sur les « médicaments vedettes » qui lui permettent de gagner les plus fortes sommes d'argent, alors même, comme le relève la Commission, que la tendance est à la baisse du nombre de nouvelles molécules sur le marché. L'innovation pharmaceutique est en panne. Chacun partage ce constat. L'industrie semble donc s'attacher à défendre l'existence des brevets et à prolonger la durée de vie des produits. Le point nous est apparu comme le coeur du problème qui se pose à l'industrie pharmaceutique.

Avez-vous pu estimer le coût des études avant la mise sur le marché mondial des médicaments ?
Il y a un prix très élevé de mise au point des nouveaux médicaments.

Les chiffres qui circulent sont de 800 millions pour la production d'une nouvelle molécule, mais ils ont été mis en cause par des auteurs comme Marcia Angell.
En ce qui concerne les fabricants de produits génériques, les ordres de grandeur sont évidemment extrêmement différents. Les coûts de production s'élèvent ainsi à 51 % du chiffre d'affaires. Ils sont ainsi plus forts que pour les laboratoires de médicaments originaux. En revanche, les coûts de marketing (13 % du chiffre d'affaires) et les coûts de recherche et de développement (7 %) sont beaucoup plus faibles. Les coûts administratifs et de distribution atteignent quant à eux au total 9 %. Pour les fabricants de génériques, en définitive, la Commission évalue à 29 % le taux de marge. Les résultats sont donc quasiment identiques à ceux des fabricants de médicaments originaux, avec des structures de coûts extrêmement différentes.
Nous restons donc extrêmement éloignés du marché parfait qui nous avait été promis, avec un produit pour le meilleur prix possible. Une marge de 30 % me semble excessive pour des produits industriels. Les laboratoires fabriquent en effet des produits industriels, et pas de la haute couture. Une marge de 30 % régulière, récurrente, dans le domaine, me semble donc excessive, particulièrement si nous y ajoutons l'impact sur les comptes sociaux, sur les comptes des différents financeurs publics ou privés, qui rencontrent de leur côté de grandes difficultés.
Nous nous sommes ensuite intéressés à la situation de la France. L'industrie est en effet essentiellement américaine. Les Etats-Unis constituent le premier marché dans le domaine. Ils représentent 42 % de la dépense pharmaceutique dans le monde pour 5 % de la population mondiale. J'ai également découvert un indice de prix relatif entre les Etats-Unis et l'Europe. Selon l'institut McKinsey, les prix américains seraient en moyenne supérieurs de 118 % aux prix moyens européens. Nous savons également que les Etats-Unis consacrent 16 à 17 % de leur PIB aux dépenses de santé. Le médicament relève par conséquent majoritairement de l'industrie américaine, avec un marché imposant, celui des Etats-Unis.

Vous insistez sur l'importance du marché américain dans l'industrie pharmaceutique. Avez-vous le sentiment d'une volonté de monopole sur l'ensemble de l'industrie ?
Je n'ai pas enquêté sur le sujet. Je ne pense pas cependant qu'un tel monopole soit à craindre. Je me suis davantage intéressé pour ma part, au-delà du constat dressé au plan mondial, à situation de la France. Nous avons trouvé une source d'information auprès de l'Afssaps, qui a publié une étude remarquable sur l'évolution du prix du médicament entre 1988 et 2008, avec les volumes des dépenses consacrées aux médicaments sur la même période. Je me suis ainsi livré à un exercice de décomposition des éléments cités entre un effet prix et un effet volume, que j'ai présenté à M. Christian Saint-Etienne, avec lequel j'ai publié un article. Ce dernier n'a par conséquent pas paru choqué par mes conclusions, qui sont pour l'essentiel les suivantes. Sur la période, l'augmentation de la dépense tient moins à des effets de volumes qu'à des effets liés aux prix. 150 % d'effets liés aux prix expliquent ainsi l'augmentation du volume des dépenses pharmaceutiques en France en vingt ans. Pour un produit industriel, le taux est extrêmement important, plus important d'ailleurs que dans d'autres pays. Un auteur, M. Philippe Pignarre, a signalé pour sa part qu'entre 1993 et 2001, les prix en France avaient augmenté de 67 % contre 18 % en Allemagne. Les prix des produits pharmaceutiques en France au cours des vingt dernières années ont donc beaucoup augmenté.
Les explications que nous avançons sont liées à la construction du marché européen, à la politique interne, à la création de l'Organisation mondiale du commerce (OMC) par l'accord de Marrakech en 1994, et donc à l'arrivée sur le marché européen et français en particulier des laboratoires américains. L'Afssaps fait remarquer à cet égard au terme de son étude que, dans la même période, le marché français s'est énormément internationalisé. Elle fait remarquer en effet que, en 1988, vingt-neuf produits sur les cinquante produits les plus vendus en officine étaient français. En 2008, ils ne sont plus que douze produits, tandis que pour l'hôpital ces chiffres sont passés de douze à sept. La part des producteurs français sur le marché français a ainsi grandement diminué, avec une internationalisation du marché sous l'effet des politiques européennes et de la création de l'OMC.
Poursuivant notre recherche sur le niveau des prix européens, nous avons trouvé des résultats publiés dans le rapport de la Medical Expenditure Panel Survey (MEPS) de 2008 et les données d'Eurostat. Ils aboutissent globalement à un résultat identique pour la France, qui resterait un pays où les prix sont plutôt bas relativement aux autres pays européens (l'Allemagne et l'Italie étant les pays aux prix les plus élevés). En France, les prix, même après avoir beaucoup augmenté, restent ainsi modérés. En revanche, dans le même temps, les pratiques de consommation en volume des médicaments sont sorties de la norme observable chez la plupart de nos voisins. Le rapport de la MEPS a communiqué un certain nombre de données sur le sujet. Les Français, par exemple, consomment neuf fois plus de psychotropes que les Allemands. En France, nous avons donc maintenu des habitudes de consommation importantes voire excessives en volume, avec un effet d'augmentation du niveau des prix très important au cours des vingt dernières années.
Nous nous sommes ensuite intéressés à la manière la mieux appropriée pour maîtriser la dépense.

Je souhaite auparavant revenir sur l'évaluation et le contrôle du médicament. Vous proposez de transférer la responsabilité de fixer les prix à l'assurance maladie et de lui donner la possibilité de lancer des appels d'offres en matière de génériques. Pouvez-vous détailler la structure institutionnelle que vous envisagez pour le circuit du médicament, de l'autorisation de mise sur le marché (AMM) à la pharmacovigilance, en incluant la fixation des prix ? Pouvez-vous également détailler votre proposition de créer une base de données sur le médicament, alimentée par un fonds spécifique, susceptible de prévenir un certain nombre de futures crises sanitaires ?
Comme je le précisais en introduction, le point de départ de mon enquête a été économique. L'enquête a en outre été publiée au mois d'octobre dernier, avant que ne soit évoquée dans la presse la malheureuse affaire du Mediator. Les aspects économiques nous ont ainsi intéressés en premier lieu. Ils nous paraissent, quoi qu'il en soit, toujours aussi importants aujourd'hui car nous pensons que certains événements se sont produits en raison de l'existence d'une industrie très puissante, à la forte capacité d'influence sur l'opinion publique et les décideurs au travers d'un ensemble de mécanismes (les emplois qu'elle génère notamment) qui peuvent expliquer l'affaire. Pour en revenir à votre question, l'idée d'avoir recours à des appels d'offres n'est pas de notre fait. Elle vient en effet des exemples néerlandais, notamment, présents dans le rapport de la DG15. Aux Pays-Bas, où les régimes obligatoires sont en concurrence, certains opérateurs ont établi des appels d'offres qui leur ont permis d'obtenir des rabais sur le prix sur des produits génériques allant jusqu'à 80 %. Les appels d'offres s'inspirent en l'occurrence d'un système plus général mis en place en Nouvelle-Zélande. Il s'agissait de renverser le raisonnement d'acceptation des produits présentés par l'industrie selon ses intérêts. Personne ne déterminait en l'espèce le besoin en médicaments du pays et les entreprises décidaient en fonction de leur politique des produits qu'elles mettaient sur le marché.

Par vos propos, vous remettez en cause à mon sens la neutralité du comité économique des produits de santé (CEPS).
La pratique est générale et mondiale. Je vous cite un exemple qui nous vient des Etats-Unis. Aux Etats-Unis, chaque année, 100 000 décès par infections nosocomiales sont recensés. Une grande part des décès seraient notamment dus à la résistance des souches bactériennes aux antibiotiques. Les autorités américaines s'en sont émues. Les solutions qu'elles ont mises en avant consistent notamment à prolonger les brevets de l'industrie pour lui procurer davantage de revenus encore et l'inciter ainsi à reprendre ses recherches sur les antibiotiques. Dans un pays qui est le temple du libéralisme, les autorités commencent par conséquent à s'inquiéter de la latitude laissée aux entreprises de décider des produits qu'elles mettent sur le marché. L'idée a notamment été avancée d'instaurer un espace de réflexion adéquat au sein de la société pour faire face aux risques sanitaires auxquels elle est confrontée en termes de médicaments.
Le résultat de la pratique en France est le suivant. 11 000 médicaments sont répertoriés en France. Selon l'Afssaps, 500 médicaments représentent 83 % de la consommation. La moitié des 11 000 médicaments représentent, en outre, un chiffre d'affaires de moins de 100 000 euros. Nous avons donc une profusion de médicaments en France. J'ai notamment repris les études de la Caisse nationale d'assurance maladie (Cnam) sur les effets de prix en France. Nous nous apercevons que sur certains types de pathologies, il existe parfois jusqu'à quatre-vingts présentations. Je pense que de ce fait résulte une surcharge pour les autorités sanitaires chargées de surveiller un nombre extrêmement élevé de médicaments, dont une certaine part est arrivée sur le marché sans apporter d'amélioration du service médical rendu. Nous constatons ainsi une arrivée, année après année, de médicaments dits nouveaux qui n'apportent pas de progrès thérapeutiques et qui ne contribuent que médiocrement à la maîtrise des prix. Il s'agit d'une réelle difficulté. Pour surveiller l'affluence de médicaments, nous ne disposons peut-être pas du système qui convient. Je reconnais que je ne réponds pas à votre question. Je répète cependant que mon approche initiale était économique.
Non. Mon propos portait sur les médicaments originaux et les médicaments génériques, aujourd'hui en grand nombre.

Selon vous, devrait-il appartenir à l'assurance maladie de fixer les prix ?
Je pense qu'effectivement, l'assurance maladie devrait avoir une voix plus forte sur le sujet. Elle reste en effet le financeur.

Vous n'avez pas en revanche réfléchi sur la structure institutionnelle concernant le circuit du médicament...
Non. Je n'ai pas enquêté sur le sujet, mais l'assurance maladie possède les informations nécessaires dans une base de données très riche. L'assurance maladie obligatoire finance 75 % des dépenses, et les assurances complémentaires 11 %. Un enjeu est la maîtrise des dépenses pharmaceutiques, double de celles de l'Angleterre et supérieures d'un quart à celles de l'Espagne. Nous avons en France des dispositifs techniques sans commune mesure avec ce que nous dépensons, tandis que les médecins demandent qu'on leur laisse la liberté de prescrire.

Il y a toujours plusieurs paramètres dans une équation. Ce niveau de dépenses n'est-il pas également lié au large niveau de prise en charge par la protection sociale ? La carte Vitale donne une impression de gratuité...
La responsabilisation, notamment des médecins, est un autre paramètre. Si le généraliste a obtenu d'être rémunéré comme un spécialiste, il doit être un spécialiste de la prescription.

Peut-on mettre en relation ce paramètre avec la générosité du système de protection sociale ?

Aux Etats-Unis où il n'y a pas de système du tiers payant, les dépenses de santé atteignent 18 % du PIB, soit un niveau très supérieur à celui de la France, et cinquante millions de personnes n'ont pas de couverture de sécurité sociale. La balance bénéfice-risque plaide vraisemblablement pour le système du tiers payant.
Enfin, pour les médecins, refuser de prescrire un médicament prend plus de temps que de refuser une prescription. Les médecins français ne prescrivent-ils pas trop, sous l'influence des laboratoires ?

Par ailleurs, selon vous, qu'est-il possible d'attendre enfin de la liste des soixante-dix-sept médicaments sous surveillance ?
Je n'ai pas regardé la liste. Je n'ai simplement pas l'impression que la liste, en termes économiques une nouvelle fois, soit d'ampleur. Le problème du Mediator est très particulier. L'entreprise qui le produit a eu un comportement particulier. Je n'en dirai pas davantage. Il s'agit d'un point de vue personnel.
Je serai extrêmement prudent. Simplement, j'ai lu le livre de Mme Frachon et le rapport de l'Inspection générale des affaires sociales (Igas). Ils comprennent des indications sur un phénomène qui reste relativement particulier. Pour ma part, j'étais intéressé par la notion d'équilibre de nos systèmes de santé dans la durée et par le poids, que je considère comme excessif, du médicament dans les dépenses que le système entraîne, en ville comme à l'hôpital. Le Ceps dit qu'il est vigilant sur les prix à l'hôpital. En ce qui concerne le médicament de ville, qui est le poste qui nous a intéressés, nous pensons que des économies importantes sont notamment réalisables, mais le coût des traitements est plus élevé en France du fait notamment de la pression des visiteurs médicaux.

L'audition étant publique, je dois vous demander, en application de l'article L. 4113-13 du code de la santé publique, de nous faire connaître, si vous en avez, vos liens avec des entreprises produisant ou exploitant des produits de santé ou avec des organismes de conseil intervenant sur les produits concernés.
Je vous remercie en premier lieu d'inviter en mon nom la médecine générale, qui est hautement concernée par le sujet qui nous intéresse.
Je suis aujourd'hui président du Conseil de la médecine générale. J'ai également été, durant huit, ans président du Collège national des généralistes enseignants, qui est une structure qui gère l'enseignement de la médecine générale. Elle a contribué à la création de la discipline et du diplôme d'études spécialisées. J'ai quitté la présidence du Collège national des généralistes enseignants au mois de novembre dernier. Auparavant, dans le cadre de mes fonctions, j'ai eu à gérer un conflit d'intérêts au sein même du Collège national des généralistes enseignants puisque les activités de recherche de type scientifique ont donné lieu à un certain nombre de partenariats avec le monde de l'industrie pharmaceutique. J'en citerai trois principalement : un partenariat avec Sanofi Aventis pour la production d'un recueil bibliographique en médecine générale réalisé chaque année qui recense les cent articles scientifiques les plus contributifs à l'activité de la médecine générale ; un partenariat avec GSK dans le cadre des formations qui touchent à la fois au secteur du patient dépressif et au secteur de la relation entre le patient et le médecin ; un partenariat avec les laboratoires Pierre Fabre puisque j'ai personnellement dirigé un travail de recherche sur les carences en fer sans anémie chez la femme. Il s'agit des trois conflits d'intérêts que je souhaite nommer.

Il s'agit de liens d'intérêts. Il convient en effet de distinguer le lien d'intérêts et le conflit d'intérêts. Il ne s'agit pas en l'occurrence de liens d'intérêts personnels.
Absolument. Il s'agit de liens d'intérêts qu'entretient mon collège avec certains laboratoires par des contributions à l'activité de médecine générale. En ce qui me concerne, je n'ai aucun lien d'intérêts personnel dans le sens d'une rémunération versée par les structures citées dans le cadre d'une activité ponctuelle ou pérenne.

Je ne mets pas en doute votre intégrité. Ne pensez-vous pas simplement que, dans la période actuelle, le fait qu'une société savante comme la vôtre soit financée même partiellement par l'industrie pharmaceutique puisse porter ombrage à la qualité ou à l'impartialité des préconisations qu'elle peut être amenée à émettre ? La question se pose. Je tiens à vous rassurer cependant. Vous n'êtes pas la seule société savante affrontant une telle situation.
A mes yeux, il existe effectivement une difficulté que je souhaiterais voir résolue et disparaître. Elle ne touche pas cependant uniquement les sociétés savantes. Par exemple, dans l'Université, nous retrouvons des difficultés analogues. L'ensemble du système en réalité (pas uniquement la recherche) fait que la participation de l'industrie pharmaceutique est à ce jour incontournable. Toutefois, la gestion que j'opère de la relation avec l'industrie pharmaceutique ne m'empêche pas de me sentir libre de parole. En outre, dans le cadre des relations que nous avons instituées avec l'industrie pharmaceutique presque davantage par nécessité que par obligation, moins de 15 % de l'activité tourne autour des subsides concernés.

N'avez-vous pas peur d'être manipulé par l'industrie pharmaceutique ? Les laboratoires en effet ne sont pas des philanthropes. En l'occurrence, ils financent une activité comme la vôtre car ils y trouvent un intérêt. Ils espèrent un retour sur investissement. Ne risquez-vous pas dès lors inconsciemment, même si vous êtes libre de parole, d'être manipulé ?
La réponse à votre question réside dans le fait que la situation ne doit pas être inconsciente. Il convient de rester conscient de la situation. Je reconnais que la tâche est complexe. A chaque étape, la réflexion ne doit pas se détourner cependant de cette considération.

Pensez-vous par exemple que, lorsque vous êtes interrogé à l'occasion d'une table ronde sur un médicament produit par Sanofi Aventis, comme cela a pu se produire, vous pouvez avoir un jugement parfaitement objectif ?
Je ne peux avoir un jugement que sur la notion de prise en charge des troubles du rythme cardiaque chez un patient mais en aucun cas sur l'impact du médicament. Je garde simplement à l'esprit l'ensemble des procédures thérapeutiques qui existent et la manière de les utiliser. En aucun cas, en revanche, je ne peux avoir une opinion sur un médicament. Tel n'est pas mon métier.

Tel n'est certes pas votre métier. Il reste cependant que vous avez participé sur une radio financée par Sanofi Aventis à un tel débat. Je n'interdis pas pour ma part de participer à un débat sur une radio financée par un laboratoire. Simplement, le problème commence à devenir inquiétant lorsque des médecins qui participent à une table ronde ne présentent pas préalablement les liens d'intérêts qu'ils peuvent entretenir avec le laboratoire concerné, y compris à travers le collège pour lequel ils travaillent. Un tel oubli est en effet susceptible de générer des doutes chez certains médecins. Vous lisez probablement la revue Prescrire. Dans la rubrique du courrier des lecteurs, vous avez pu constater ainsi que vous avez été mis en cause par un médecin généraliste qui a décidé de ne plus écouter la radio dont il est question. Il s'agit d'un vrai problème. Si j'en avais le pouvoir, je souhaiterais de mon côté que les sociétés savantes n'aient plus rien de commun avec l'industrie pharmaceutique. Un tel souhait est en réalité un rêve. Au minimum, néanmoins, l'ensemble des sociétés savantes devraient afficher les relations qu'elles entretiennent avec l'industrie pharmaceutique sous peine de voir les situations de liens stigmatisées par les observateurs.
Je tiens à préciser simplement que dans le cadre de la table ronde, je me suis exprimé sur la prise en charge des patients et non sur le produit en tant que tel. Tel n'était pas en effet mon propos. Je me plaçais simplement dans la pratique médicale.

Aucun des médecins présents à la table ronde n'a indiqué les liens d'intérêts, qui étaient en réalité des conflits d'intérêts, qu'il entretenait avec l'industrie pharmaceutique, contrairement aux termes de la loi. Les mentalités doivent changer. Dès lors qu'un professionnel de santé s'exprime, il doit en effet préciser s'il entretient ou pas un lien avec le laboratoire qui produit le médicament sur lequel porte l'intervention. Vous avez à présent la parole.
Je commencerai par un constat. Dans de nombreux pays, l'organisation des soins est clairement structurée et le rôle de la médecine générale identifié en tant que soins primaires, non dans les mots comme en France où le médecin traitant n'a pas les moyens de jouer son rôle de « pivot du système ». Ces systèmes fonctionnent plutôt mieux et pour des coûts plus faibles (au Royaume-Uni par exemple) que dans ceux où les spécialistes par appareil ont l'exclusivité des médias et l'oreille des institutions. Mon expérience pendant des années à la commission de transparence a été édifiante sur ce point : travail préparatoire bénévole, rapport écrit et oral, exclusion des débats, et décision souvent loin des conclusions.
J'évoquerai le rapport de l'Igas. Il se suffit à lui-même.
D'une part, il est violent à l'égard de l'industrie et des agences, d'autre part, il préconise dans sa conclusion de s'appuyer sur les médecins (sans précision aucune) et les patients (sans précision dans le texte du rapport) pour éviter ce type de situation à l'avenir. Le rapport pointe relativement bien l'archaïsme du système de pharmacovigilance et les raisons de sa prévisible inefficacité (au-delà de l'éventuel dysfonctionnement critique que cette affaire a pu révéler). Il ne propose pas réellement d'alternative ; il précise cependant que sans les médecins, rien n'est possible. Je veux évoquer pour ma part la nécessité d'une recherche en médecine générale, clinique, sur le terrain, dotée de moyens. Elle débute mais n'est pas encore assez favorisée et reconnue, même si nous pouvons nous réjouir de son entrée dans le cadre d'un volet spécifique du programme hospitalier de recherche clinique (PHRC).
A propos de l'oubli catastrophique de la médecine générale dans le système, j'indiquerai que l'approche globale du médecin généraliste est un moyen approprié pour détecter certains dysfonctionnements de notre système sanitaire. Le généraliste, souvent le médecin de famille, connaît le patient dans toute sa complexité. Il peut détecter des « effets de bords des médicaments », imprévus ou sous-estimés, quand des spécialistes traitent des « tranches » de santé. Je pense que M. le président de cette commission ne me démentira pas. Il partage cette expérience.
Actuellement la médecine générale est encore privée de la reconnaissance universitaire. Elle doit quémander et militer en permanence pour développer l'embryon de filière qui lui est concédé avec réticence. Le généraliste, son rôle, son efficacité, restent en France trop ignorés tant du système de santé et de ses financeurs que de l'université. Aujourd'hui les éléments même de la loi HPST qui concernent la discipline et sa filière ne sont toujours pas respectés. Les moyens ne sont pas au rendez-vous, avec vingt professeurs titulaires et cent cinquante enseignants associés pour former plus de 50 % des étudiants en médecine.
L'investissement sur la médecine générale n'est toujours pas réalisé concrètement par l'assurance maladie, qui cherche prioritairement à effectuer des économies dans ce secteur alors que les marges économiques sont à l'évidence dans le coût des plateaux techniques. Cet investissement n'est pas opéré par les tutelles qui « raccommodent » en permanence le système de santé, sans prendre en compte le fait que lorsque le tissu est trop déchiré, les reprises ne peuvent pas tenir.
Privé de la sentinelle, du relais essentiel que représente la médecine générale, le système sanitaire français est aveugle, puisque la grande majorité des actes médicaux et des prescriptions médicamenteuses est réalisée en soins primaires. Il réagit au gré des données issues du contexte hospitalier, de son hyperspécialisation, de la puissance des lobbies, des liens confus entre l'hôpital, l'université, la formation, la recherche d'une part, et les industriels d'autre part. Des médecins généralistes mieux installés en faculté, mieux représentés dans les institutions sanitaires auraient certainement pu constituer un frein aux errements actuels, dont le Mediator n'est que la partie émergée.
Dans les faits, la revue Prescrire a été créée par des médecins généralistes. Elle fonctionne majoritairement avec des médecins généralistes abonnés. Les principaux lanceurs d'alerte sur les conflits d'intérêts et leurs conséquences sur la thérapeutique sont des médecins généralistes. Dans les faits, l'enseignement systématique sur les rapports bénéfice-risque de la thérapeutique médicamenteuse est effectué en troisième cycle de médecine générale, quand les moyens des départements de médecine générale le permettent.
Pour revenir au Mediator, j'ajouterai que le parcours de ce médicament illustre la nécessité d'un regroupement des différentes agences et commissions intervenant dans la politique du médicament, jusqu'à un guichet unique, où la médecine générale puisse être présente, où la pertinence clinique de l'effet du médicament soit prise en compte, où il ne puisse y avoir de décision politique dans un domaine purement technique. Ainsi, dans son avis de 1999, la commission de la transparence a considéré que le service médical rendu (SMR) du Mediator était insuffisant dans ses deux indications, position qui, de facto, aurait dû aboutir à un déremboursement. Il serait donc intéressant de savoir pourquoi les ministres de l'époque (Aubry, Kouchner) n'ont pas suivi l'avis de la commission, signant la poursuite du remboursement (qui plus est à 65 %). A cet égard, il serait intéressant également que le Sénat demande la liste des médicaments qui ont eu un SMR insuffisant à cette époque, pour regarder quels sont ceux qui ont préservé leur remboursement, pour mesurer l'étendue des incohérences. Par ailleurs, dans son avis de 2006, la même commission (avec un président différent) a émis un avis de SMR insuffisant dans l'indication « hypertriglycéridémie » du Mediator. Elle réservait en outre son avis sur l'indication « traitement d'appoint du diabète » dans l'attente des conclusions de la pharmacovigilance. Pour expliquer une telle différence entre 1999 et 2006, citons l'étude Moulin qui était plutôt en faveur d'une discrète efficacité de Mediator sur l'HbAlc, sans prise en compte de la pertinence clinique de cet effet.
J'ajoute qu'il convient d'être prudent sur le chiffre des décès (annoncé entre cinq cents et deux mille décès) car il s'agit d'une estimation construite avec un modèle statistique et non pas d'un comptage précis.
Je propose d'être également prudent sur la notion de prescription hors AMM car je rappelle l'indication : adjuvant du régime adapté dans les hypertriglycéridémies, idem dans le diabète avec surcharge pondérale. Nous savons que prise individuellement, l'hypertriglycéridémie (HTG) n'est pas un facteur de risque cardio-vasculaire tandis que les résumés des caractéristiques des produits (RCP) précisent que l'efficacité de la prévention primaire et secondaire des complications de l'athérosclérose n'est pas prouvée. Il en est de même pour de nombreux produits anti-cholestérol de première génération prescrit larga manu sans bénéfice pour les patients pendant des années. L'absence de guichet unique est évidemment une source de confusion majeure. L'AMM n'a pas de rapport avec la pertinence clinique, n'a pas de rapport avec les avis de la transparence, n'a pas de rapport avec le remboursement. Le problème de la prescription hors AMM n'est qu'une conséquence de la confusion qui existe. Le fait de se centrer sur ce sujet évitera d'aborder les vrais problèmes.
Quoi qu'il en soit, le système est prêt pour un nouveau scandale. La persistance sur le marché de médicaments d'efficacité douteuse et remboursés pendant de nombreuses années pose problème en soi. Elle met directement en cause les agences d'Etat et les décideurs. Les professionnels ne peuvent pas être les garde-fous d'un « système incohérent ». L'information et la formation des médecins, indépendantes de toute influence, sont difficiles à obtenir. Les outils permettant d'y contribuer n'ont pas été encouragés, par exemple les moyens de la formation initiale universitaire des généralistes toujours actuellement ridicules, les revues indépendantes de type Prescrire, dont la diffusion ne pénètre pas l'hôpital et les CHU, lieu emblématique de la formation initiale, une base de données médicamenteuse indépendante de type Theriaque, une formation indépendante de type formation professionnelle continue (FPC) indemnisée et réalisée sur le temps de travail dont les budgets diminuent pour laisser place au développement professionnel continu (DPC) et qui ne priorisent pas la réflexion sur la thérapeutique, la pharmacovigilance en soins primaires, confinée au bénévolat en plus de toutes les tâches des médecins et non rémunérée dans le système du paiement à l'acte.
Le système reste suffisamment incohérent pour que les recommandations qui sont censées être une base de réflexion pour le médecin privilégient des médicaments d'efficacité relative et sans aucun bénéfice clinique à terme, sur des critères intermédiaires, sans bénéfice pour les patients et avec des incidences économiques majeures. Le traitement médicamenteux de la maladie d'Alzheimer est un exemple caricatural d'une telle dérive.
Dans les faits, les médecins généralistes sont mis devant le fait accompli de la prescription des anti-Alzheimer (AC) qu'ils n'ont pas le droit de prescrire en première intention, mais sont supposés entériner en tant que médecin traitant la prescription hospitalière « spécialisée » devenue systématique de ces produits coûteux. Ils ont constaté que l'augmentation considérable du nombre de patients, la pression industrielle pour fournir une thérapeutique dans un marché en expansion massive, la pression sociétale illustrée par un plan ministériel, devenaient des justifications pour utiliser massivement des traitements inefficaces et dont le rapport bénéfice-risque est par définition défavorable. Ces traitements ont eu une AMM puis une évaluation de la transparence surréaliste avec un avis qui conditionne son utilisation abusive d'où est absente toute pertinence clinique.
Le terme même de médecin traitant traduit ce malaise : le médecin généraliste n'est plus décideur dans le soin ; il est traitant, donc contraint d'appliquer des directives venues d'ailleurs (protocoles, recommandations, décisions hospitalières ou spécialisées) sous peine de déconsidération voire d'attaques. Dans la réalité, nous sommes quasi quotidiennement confrontés au dilemme de poursuivre des traitements inutiles, coûteux et iatrogènes ou de les arrêter avec les difficultés qu'une telle décision entraîne avec les confrères, les patients et leurs familles.
Dans les faits, les médecins généralistes sont écartés des décisions en cancérologie concernant leurs patients car rien n'est prévu pour leur permettre d'assister aux réunions de concertation pluridisciplinaires. Les médicaments inutiles, iatrogènes et coûteux en cancérologie constituent probablement l'autre grand secteur où le circuit du médicament aboutit à des décisions que paient au sens propre comme au sens figuré les malades. Les soins pratiqués par les médecins généralistes sont peu onéreux, faciles d'accès pour les patients. Ils supportent en outre la comparaison avec les soins spécialisés. Pourtant le risque en France est de voir disparaître le plus pratique et le plus concret des garde-fous qui pourrait être efficace si les moyens lui étaient donnés.
La question qui se pose est grave : est-il encore temps de réagir ? Les jeunes médecins ont été formés à l'hôpital, qui n'est pas tendre pour ceux qui ne viennent pas du sérail. De longues années seront nécessaires avant de les convaincre de revenir vers le merveilleux métier qu'est ou malheureusement qu'était la médecine générale. Ces longues années risquent de coûter extrêmement cher à la Nation.

Dans l'affaire du Mediator, les médecins généralistes sont critiqués pour des prescriptions hors AMM. Estimez-vous que la liberté de prescription des médecins doive être mieux encadrée ?
Les médecins qui ont partagé la prescription hors AMM sont nombreux : endocrinologues, diabétologues, spécialistes en obésité, nutritionnistes, généralistes. Nos confrères spécialistes ne sont donc pas étrangers à la situation. La prescription hors AMM n'en demeure pas moins le quotidien des médecins généralistes. Elle doit cependant être réalisée dans le respect de deux notions régaliennes, le signalement de la prescription et le fait que la prescription n'est pas couverte par l'assurance de responsabilité civile. A ce jour, dans l'ensemble des hôpitaux de France, des prescriptions hors AMM sont effectuées. Elles sont ensuite répercutées auprès des médecins généralistes ou spécialistes comme constituant une pratique licite. Le « consensus professionnel » engendre donc le fait que la prescription hors AMM peut être utilisée (par exemple dans le cas du Rivotril, utilisé chaque jour). Le médecin n'en doit pas moins demeurer circonspect lorsqu'il conseille un patient. La parole du médecin reste en effet d'importance dans notre société vis-à-vis du patient.

Pensez-vous par ailleurs que la formation des médecins en matière de pharmacologie doive être réformée ?
Les médicaments comprennent parfois des excipients qui sont source d'intolérance. Ce point, parmi d'autres, complexifie la situation en matière de pharmacologie. Je citerai notamment également la foultitude de génériques qui n'en sont pas car ils ne copient pas exactement le produit initial. Un médecin généraliste doit notamment, pour trouver le principe actif d'un produit, dérouler deux écrans sur son ordinateur. Si vous y ajoutez le fait que le pharmacien délivrera peut-être un autre générique, nous évoluons ainsi, dans le domaine, dans la folie totale.

Je souhaite vous poser une dernière question pour conclure. Comment votre revue Exercer est-elle financée ?
La revue Exercer, dont je ne suis plus le directeur de publication, est entièrement financée par des fonds propres et des abonnements. Elle est ainsi malheureusement déficitaire. L'année prochaine, par conséquent, elle cessera sa publication, tandis qu'elle atteignait l'étape de l'indexation. En France, malheureusement, rien n'est fait pour que des revues de qualité existent.