Commission des affaires sociales
Réunion du 15 février 2017 à 10h00
Sommaire
La réunion
La réunion est ouverte à 10 heures.

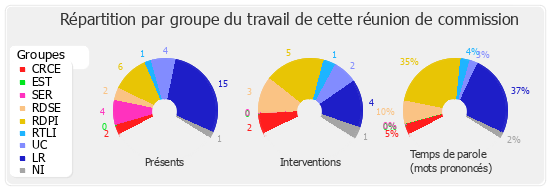
La commission des affaires européennes a adopté, le 12 janvier dernier, une proposition de résolution européenne sur les perturbateurs endocriniens dans les produits phytopharmaceutiques et les biocides. Cette proposition de résolution fait suite à un rapport d'information présenté le même jour par nos collègues Patricia Schillinger et Alain Vasselle.
Ce rapport rappelle les principales données relatives aux perturbateurs endocriniens et à leurs effets sur la santé. Il vise surtout à faire le point sur l'état des débats intervenus au cours de ces dernières années au sein de l'Union européenne, et il montre que celle-ci a considérablement tardé à prendre en compte cette problématique, alors que la règlementation des substances chimiques relève de sa compétence, et non de celle des États membres. Nous nous trouvons ainsi devant une sorte de carence de l'action européenne à laquelle les législations nationales ne peuvent se substituer.
La proposition de résolution découle plus particulièrement de l'analyse, par nos deux collègues, des propositions que la Commission européenne a formulées pour définir et donc réglementer les perturbateurs endocriniens, dans le cadre des textes relatifs aux produits phytopharmaceutiques et aux biocides.
Il m'a paru important que Patricia Schillinger et Alain Vasselle puissent nous exposer les principales conclusions de leur travail et leur sentiment, que je crois très critique, sur l'attitude actuelle des autorités européennes. Je précise que cette proposition de résolution deviendra proposition du Sénat d'ici la fin de la semaine, sauf demande d'examen en séance publique émanant d'un président de commission ou de groupe, ou du Gouvernement.

Les règlements européens encadrant l'utilisation des produits phytopharmaceutiques et des biocides prévoient l'évaluation de toutes les substances actives entrant dans la composition de ces produits. Les substances identifiées comme perturbateurs endocriniens ne sont pas autorisées, sauf dérogation. Mais ces deux règlements ne déterminent pas les critères permettant de définir un perturbateur endocrinien. Ils disposaient que la Commission européenne devait proposer une définition dans le cadre d'un acte d'exécution pour les produits phytopharmaceutiques et d'un acte délégué pour les biocides, au plus tard en décembre 2013, ce qui n'a pas été fait. Ce n'est qu'après une condamnation par le tribunal de l'Union européenne que la Commission a proposé ces critères, le 15 juin 2016.
Pour comprendre les enjeux de ces propositions, il faut savoir que le système hormonal ou système endocrinien permet de réguler le développement et le fonctionnement de l'organisme. Il contrôle ainsi la température du corps ou le taux de sucre dans le sang, mais permet aussi le développement de l'organisme et le mécanisme de reproduction. Pour cela, des glandes telles que la glande thyroïde ou les glandes génitales vont sécréter une hormone. Celle-ci va alors se fixer à un récepteur et déclencher une réaction d'un organe tiers ou l'expression d'un gène. Les perturbateurs endocriniens sont des substances qui vont imiter ces hormones et empêcher que l'organisme ne réagisse de manière adéquate.
Ces substances sont présentes partout autour de nous et il est donc difficile de s'en prémunir. En effet, on les retrouve dans la nourriture, l'eau potable et l'air où elles sont diffusées notamment par les pesticides. Ces substances sont également présentes dans certains médicaments et dans les produits cosmétiques. Le plus connu du grand public est le bisphénol A, présent notamment dans les biberons et les revêtements intérieurs des boîtes de conserve.
L'identification des perturbateurs endocriniens est rendue difficile par leur mode d'action qui diffère de celui des autres substances toxiques. Pour celles-ci, on considère en effet que la dose fait le poison. Plus la dose est forte, plus l'effet toxique observable est élevé.
Pour les perturbateurs endocriniens, la Société internationale d'endocrinologie décrit les caractéristiques suivantes : les perturbateurs endocriniens n'ont pas directement d'effet néfaste sur une cellule ou un organe ce qui génère un temps de latence qui rend l'effet indésirable plus difficile à détecter ; ce n'est pas la dose qui fait le poison mais la période d'exposition : le danger est ainsi plus grand pour les femmes enceintes et les enfants de moins de trois ans ; ils peuvent agir selon une relation dose-réponse non linéaire avec des effets à faibles doses plus importants qu'avec des doses plus élevées ; les effets peuvent se transmettre à la descendance ; la multitude des perturbateurs endocriniens entraîne un « effet cocktail » difficile à analyser.
Compte tenu de ces éléments, il est difficile de considérer les perturbateurs endocriniens comme les autres substances toxiques, et ce malgré les contestations des toxicologues. Les critères d'identification des perturbateurs endocriniens doivent tenir compte de ces caractéristiques particulières.
Aujourd'hui, on peut se féliciter que le sujet soit enfin débattu. Toutefois, on peut formuler trois griefs quant à la procédure utilisée, à savoir un acte d'exécution et un acte délégué, pris dans le cadre fixé respectivement par le règlement relatif aux produits phytopharmaceutiques et le règlement relatif aux biocides. Tout d'abord, ces critères ne s'appliqueront donc qu'aux seuls produits phytopharmaceutiques et aux produits biocides. Or, il aurait été intéressant de proposer des critères d'identification valables pour tous les produits, notamment les produits cosmétiques. En outre, les règlements de base prévoient déjà que toutes les substances actives feront l'objet d'une évaluation et que celles qui seront identifiées comme perturbateur endocrinien ne seront pas autorisées, sauf dérogation particulière. Ces dispositions ne pourront pas être modifiées dans ces actes car la Commission n'a pas mandat pour le faire. Or, il aurait été intéressant de pouvoir adapter les conséquences réglementaires aux critères retenus. Enfin, les propositions de la Commission ne pourront pas être amendées par le Conseil ou le Parlement européen, qui pourront toutefois y opposer leur veto.

La commission des affaires européennes a examiné le 12 janvier dernier les critères d'identification des perturbateurs endocriniens dans les produits phytopharmaceutiques et les biocides, que propose la Commission européenne.
S'appuyant sur la définition proposée par l'OMS, la Commission européenne a estimé qu'une substance sera reconnue comme perturbateur endocrinien si elle répond aux trois critères suivants : elle montre des effets indésirables sur un organisme sain ou sa progéniture ; elle altère le fonctionnement du système endocrinien ; ses effets indésirables sont une conséquence du mode d'action endocrinien.
Or, de l'avis des associations et des scientifiques de l'Inserm notamment, le niveau de preuve demandé pour satisfaire ces critères est trop élevé. En effet, il sera difficile de démontrer en utilisant des études scientifiques standardisées le lien de conséquence entre l'effet indésirable et l'altération du fonctionnement du système endocrinien.
Face aux enjeux sanitaires, il nous apparaît judicieux, dans le cas des perturbateurs endocriniens, d'appliquer le principe de précaution. Celui-ci prévoit que l'absence de certitudes scientifiques ne doit pas retarder l'adoption de mesures effectives, mais aussi proportionnées, visant à prévenir un risque pour la santé. Rappelons que les perturbateurs endocriniens sont un concept récent formulé en 1991 seulement. Nous proposons donc que les trois critères à prendre en compte pour identifier une substance comme perturbateur endocrinien soient les suivants : elle est connue ou présumée pour ses effets indésirables sur un organisme sain ou sa progéniture ; elle présente un mode d'action endocrinien et altère donc les fonctions du système endocrinien ; il est biologiquement plausible que ses effets indésirables soient une conséquence du mode d'action endocrinien.
Ces critères sont ceux défendus par le Gouvernement français. En considérant que ces effets doivent être connus ou présumés et en établissant que le lien entre la perturbation endocrinienne et l'effet néfaste sur la santé est biologiquement plausible, les études scientifiques non standardisées, c'est-à-dire reconnues par la communauté scientifique mais pas encore par l'OCDE, pourront être prises en compte pour démontrer qu'une substance est un perturbateur endocrinien. C'est le sens de la proposition de résolution européenne adoptée par la commission des affaires européennes le 12 janvier dernier.
En revanche, une application proportionnée du principe de précaution n'incite pas à définir une catégorie de perturbateurs endocriniens potentiels. En effet, les agriculteurs comme les industriels s'inquiètent de voir apparaître une liste noire de substances considérées comme étant potentiellement des perturbateurs endocriniens, qui même si elles ne sont pas formellement interdites, seront rejetées par les distributeurs et les consommateurs. Une étude menée par le cabinet Redqueen indique que dans ce cas, 60 substances seraient susceptibles d'être qualifiées comme perturbateur endocrinien. Cela aurait pour conséquence de remettre en cause la viabilité des exploitations qui subiraient alors une baisse de 40%, en moyenne, de leur rentabilité.
Par ailleurs, outre les critères permettant l'identification des perturbateurs endocriniens, la Commission a proposé de modifier le cadre réglementaire relatif à l'usage de ces substances. Tout d'abord, la Commission propose de revoir les conditions dans lesquelles une dérogation peut être accordée pour l'utilisation de substances reconnues comme perturbateurs endocriniens dans les produits phytopharmaceutiques. Jusque-là, une dérogation était possible en cas « d'exposition négligeable ». La Commission propose de permettre une dérogation « en cas de risque négligeable lié à l'exposition dans les conditions réalistes les plus défavorables ». Il s'agit ici d'élargir les possibilités de dérogation.
De même, dans sa version du 8 décembre 2016, la Commission européenne a ajouté un paragraphe aux deux projets d'actes concernant les critères d'identification des perturbateurs endocriniens dans le cas des organismes non ciblés. Ces dispositions doivent permettre de ne pas interdire les substances dont le mode d'action est précisément de perturber le système endocrinien des organismes nuisibles, si pour les êtres humains, il est démontré que l'effet néfaste n'est pas avéré.
Nous considérons ici que la Commission outrepasse ses droits. En effet, ces modifications, inscrites dans un simple acte délégué ou d'exécution, remettent en cause des dispositions essentielles des règlements qui constituent la base juridique de cet acte. Elles devraient donc faire l'objet d'un nouveau règlement si la Commission souhaite les modifier.

En dépit de la grande qualité de l'exposé qui vient de nous être fait, je ne suis pas certain de bien comprendre la position exprimée par M. Vasselle. Vous nous expliquez que la France, qui est en avance sur ces questions, doit demander à l'Europe de prendre des mesures permettant d'assurer une meilleure protection à l'échelle européenne, tout en nous mettant en garde contre le danger qu'il pourrait y avoir à aller trop loin dans la réglementation lorsque nous n'aurions à faire qu'à de simples soupçons concernant l'effet de telle ou telle substance. S'agit-il là d'une position personnelle, ou cela figure-t-il dans le texte que vous nous soumettez ?

Pourquoi ne pas avoir suivi la recommandation récemment formulée par l'Anses quant aux critères de définition des perturbateurs endocriniens ? À vouloir se montrer trop prudent, on risque de se montrer trop accommodant envers les industriels. Pourriez-vous par ailleurs nous donner quelques précisions sur le groupe international qui sera constitué, s'agissant notamment de sa composition ?

La mort tragique d'un nourrisson survenue dans un établissement hospitalier à la suite de l'administration de vitamine D à forte dose a pu susciter quelques interrogations. La définition des perturbateurs endocriniens que vous nous proposez pourrait-elle englober ce cas de figure ?

La distinction faite entre les perturbateurs endocriniens présumés et suspectés m'interpelle. Il est bien évident que l'innovation ne peut se faire que dans le respect de la santé humaine. Cependant, on ne peut accepter des délais exagérément longs pour la mise sur le marché de nouvelles molécules, ni continuer à travailler, dans certains domaines, avec des molécules du XXe siècle, quand il en existe d'autres qui pourraient permettre des avancées considérables. Comment donc concilier vos observations avec le principe d'innovation ?

C'est une question difficile que nous abordons aujourd'hui - j'en sais quelque chose, puisque je suis l'auteur d'un rapport sur ce thème produit en 2011 par l'Opecst. Plusieurs éléments de cette proposition de résolution m'interpellent, et notamment l'articulation entre ses alinéas 14 (« Considérant que la Commission a déterminé trois critères concomitants pour permettre l'identification d'une substance comme perturbateur endocrinien : un effet néfaste sur un organisme sain, une altération du système endocrinien et un lien de conséquence entre le premier et le second ») et 21 (« Considérant que des critères d'identification, reposant sur des études permettant seulement de suspecter que la substance est un perturbateur endocrinien, auraient pour conséquence de diminuer la production et la rentabilité des exploitations agricoles, et d'autres secteurs d'activité de manière excessive »).
Des travaux scientifiques sont encore en cours sur des dizaines de milliers de substances, qui vont encore durer plusieurs années. Il faut par ailleurs garder à l'esprit que les perturbateurs endocriniens ont des effets très différents selon les organismes et les périodes de la vie ; certains sujets fragiles, comme les femmes enceintes ou les enfants en croissance, y sont particulièrement exposés. Sur un organisme adulte tel que le mien, il me semble en revanche que les perturbateurs endocriniens n'ont plus qu'une faible marge de manoeuvre...
Je m'interroge également sur l'utilisation du terme de « phytopharmaceutiques », qui fait par ailleurs écho à celui de « phytosanitaire ». Certains médicaments sont par définition des perturbateurs endocriniens, comme ceux utilisés pour traiter les problèmes de thyroïde.

La conciliation de la protection du public face à des substances suspectées d'avoir un effet nocif avec certains enjeux économiques apparaît en effet difficile. Je pense notamment aux recherches actuellement menées sur une substance qui aurait pour effet de piéger les insectes, sur lesquelles il y a encore beaucoup de progrès à faire, et rejoins sur ce point la préoccupation exprimée par mon collègue René-Paul Savary.
La question qui se pose aujourd'hui est celle de la manière dont les interdictions seront harmonisées à l'échelle européenne : la France ne doit pas se retrouver seule à appliquer certaines d'entre elles. Il me paraîtrait par ailleurs intéressant de mettre en place, en complément et dans certains territoires exposés, des chartes entre associations de protection de l'environnement et producteurs visant à limiter les plantations proches des maisons et à signaler par avance les moments d'épandage.

Comme plusieurs de nos collègues je m'interroge sur le champ de la recherche. Il est question des produits phytopharmaceutiques et de biocides. Vous évoquez aussi les produits cosmétiques et les emballages plastiques. Comment guider la recherche sur tous les sujets alors que, comme le soulignait Gilbert Barbier, le terrain joue également beaucoup sur l'impact de ces substances ?
Je crains que nous ne stigmatisions certains produits tout en passant à côté d'autres qui seraient plus dangereux. À mon sens il faut en tous cas approfondir cette question.

J'ai, pour ma part, une remarque de forme. L'initiative prise par la France est louable mais le texte de la résolution ne me paraît pas à la hauteur de la sonnette d'alarme que nous souhaitons tirer. Je note que nous « invitons », que nous « estimons nécessaire », que nous « encourageons ». Tout cela me paraît trop gentil et peu propice à obtenir plus d'investissement dans la recherche sans laquelle nous n'aurons pas d'arguments à faire valoir. Un seul paragraphe me donne satisfaction. Celui où nous nous opposons « fermement ». Je pense qu'il faut utiliser des mots qui réveillent !

J'ai une remarque de nature économique et une remarque de forme.
Sur l'économie, le considérant 21 de la résolution affirme qu'il faut limiter les effets des mesures prises sur les exploitations agricoles et les autres secteurs d'activité, sans préciser lesquels. Or le considérant 22 veut inclure dans le champ de la recherche la cosmétique. Il faudrait prendre pour ce secteur, qui a une importance particulière en France, les mêmes précautions que pour les exploitations agricoles. Ces deux paragraphes ne me paraissent pas très cohérents.
Je ne reviens pas sur le règlement REACH qui a déjà été évoqué simplement pour dire qu'il a été négocié pendant plusieurs années avec une forte mobilisation de l'industrie chimique.
Il y a également un problème de forme. Les considérants 23, 24 et 30 regrettent le recours à acte d'exécution qui empêche le Parlement européen d'intervenir et indiquent que la Commission ne serait pas compétente en la matière.
La Commission est-elle prête à bouger face à cette argumentation juridique ? Quelles sont les chances d'aboutir à un débat public par les instances élues ? Il ne sert à rien à la France d'être en avance si elle est toute seule.

Le sujet est effectivement large et donne parfois l'impression qu'on ne peut plus rien boire, ni manger, ni respirer. Nous manquons aussi de travaux sur les effets à long terme et sur les différentes générations de ces produits. La France est précurseur mais il s'agit d'un enjeu de santé publique mondial qui demande une plus grande concertation. Nous avons constaté que les agences spécialisées ne se concertent pas suffisamment. Au niveau politique également je pense qu'il faudrait également organiser des réunions régulières entre les parlementaires concernés et le commissaire européen en charge de la santé.
Il faut également garantir l'indépendance de la recherche et avoir des experts qui soient de véritables référents nationaux.
On ne doit pas également négliger l'enjeu en matière d'importation et d'exportation des produits. Une molécule de remplacement met quinze ans à être à mise sur le marché. Certains produits biocides sont d'usage quotidien, comme les gels hydroalcooliques. On ne peut donc tout interdire du jour au lendemain, il faut procéder par étapes même si une large part du travail a déjà été accompli puisque 700 des 1 000 substances identifiées ont déjà été retirées du marché.
S'agissant des suites données à nos travaux, nous nous réunissons le 28 février et nous allons tâcher d'avoir un entretien par visioconférence.

Je comprends que la question qui nous réunit puisse susciter beaucoup d'interrogations compte tenu des enjeux de santé publique.
M. Desessard s'est interrogé sur la référence que nous faisons aux risques économiques qui pourraient résulter de l'interdiction de produits suspectés. Pourquoi écarter ces derniers ? Les produits présumés, ou ceux considérés comme présentant un danger, ont fait l'objet de suffisamment d'études scientifiques qui permettent d'identifier les dangers présumés que leur usage fait courir. Nous considérons, comme le Gouvernement français, que ces produits doivent être intégrés à la réglementation européenne. A l'inverse, les produits suspectés sont ceux pour lesquels l'état des connaissances scientifiques est tel que nous ne sommes pas en mesure de démontrer leurs effets indésirables sur la santé. Comme Patricia Schillinger l'a indiqué, la possibilité de développer des molécules de substitution pose la double question du coût et du temps, dix à quinze années étant nécessaires. Concernant les produits présumés, nous ferions déjà un pas en avant considérable alors qu'un certain nombre d'États européens freinent des quatre fers.
Mme Bricq a évoqué l'article 78 du Règlement européen. Les procédures européennes sont très encadrées. L'article 78 ne prévoit pas que la Commission européenne puisse se prononcer sur l'évolution de la réglementation des perturbateurs endocriniens. Celle-ci ne s'applique pas aux produits cosmétiques.
Pour répondre à M. Vanlerenberghe, l'évolution réglementaire qui nous intéresse concerne uniquement les produits phytopharmaceutiques et biocides et non les produits naturels. Ces derniers feront l'objet d'une évolution réglementaire distincte.
Le caractère insuffisamment incisif ou affirmatif de la résolution a été soulevé par M. Vergoz. Il faut garder à l'esprit le fait que la France n'a pas de compétence directe dans la matière qui nous intéresse. Elle ne peut contraindre la Commission européenne. Nous ne pouvons qu'émettre des encouragements ou des incitations.
S'agissant de la recherche, nous avons tout de suite pris en compte la nécessité d'insister sur la coordination et la concertation, en particulier dans la communication. Il n'existe pas de position commune affichée au niveau européen entre l'ensemble des États membres. Nous organiserons peut-être un colloque sur ce thème et une réunion à laquelle seraient invités tous les États membres afin d'aller dans le sens d'une harmonisation de nos positions et d'une meilleure communication.
Il faut aller beaucoup plus loin en matière de recherche. Les résultats arrivent toujours avec un temps de retard. Par exemple, nous avons obtenu des résultats il y a peu de temps concernant le DDT, un insecticide. Démonstration a été faite qu'une simple exposition pouvait entraîner une perturbation du système endocrinien. Cela nous encourage à inciter le développement de la recherche. L'ensemble des scientifiques doivent pouvoir se concerter plus régulièrement afin de faire le point sur la recherche de telle manière à ce que cela puisse contribuer à l'évolution de la réglementation.

A-t-on identifié les perturbateurs endocriniens qui sont à l'origine de cancers du sein ou de la prostate ?

L'identification précise est rendue difficile par l'effet cocktail que nous avons évoqué. En tout état de cause, les médecins constatent beaucoup d'évolutions liées au changement hormonal, en particulier chez les jeunes dont le développement physique est de plus en plus précoce.

Pour compléter les éléments de réponse à l'interrogation de Mme Bricq, je souhaitais préciser qu'en tant que rapporteurs nous définissons des critères d'identification des perturbateurs endocriniens mais pas les conséquences réglementaires.

Monsieur le sénateur Claude Huriet, monsieur le professeur, c'est avec plaisir que nous accueillons aujourd'hui votre retour devant la commission des affaires sociales du Sénat.
Je rappelle que votre action au sein de notre commission a permis la création de nombreuses instances qui sont aujourd'hui au coeur de notre système de santé, au premier rang desquelles la Haute Autorité de santé.
Vous avez par la suite continué à vous intéresser à nos travaux en tant que président du conseil d'administration de l'Institut Curie.
Mais nous vous entendons aujourd'hui sur un sujet qui a récemment défrayé l'actualité, celui de la recherche biomédicale, dont le cadre a été posé par la loi du 20 décembre 1988 connue sous le nom de loi Huriet-Sérusclat.
Nous nous en étions entretenus il y a quelques semaines et étions convenus de cette rencontre.
Il nous a en effet semblé important d'avoir votre regard sur la situation actuelle et sur les enjeux qui, finalement, n'ont guère évolué depuis le premier bilan de la mise en oeuvre de la création des comités de protection des personnes participant à la recherche biomédicale, que vous aviez dressé, pour notre commission, il y a plus de quinze ans, en 2001.
J'ai d'ailleurs fait tirer des exemplaires de ce rapport pour le mettre à la disposition de nos collègues.
Si je suis parmi vous aujourd'hui, ce n'est pas tant comme professeur que comme sénateur honoraire, ancien membre de la commission des affaires sociales.
La loi Huriet-Sérusclat est née ici, dans votre assemblée. C'est le mérite de la commission des affaires sociales du Sénat de l'avoir conçue, présentée et soutenue. Je profite de ce moment d'émotion pour évoquer le souvenir de Franck Sérusclat. C'est une loi très innovante, non seulement parce qu'elle a été la première loi de bioéthique mais aussi parce qu'elle a inscrit dans notre droit le principe du consentement. C'est aussi un texte d'initiative sénatoriale. Or très peu de propositions de loi sénatoriales obtiennent un vote quasi unanime des deux assemblées. Ce résultat a été rendu possible grâce au compagnonnage entre Franck Sérusclat, ancien pharmacien et socialiste, et moi-même, médecin et centriste ! Nous avons été capables de nous entendre pour bâtir conjointement un texte, préfigurant en cela l'unanimité qui s'est exprimée lors de son adoption.
Quel est l'esprit initial de la loi Huriet-Sérusclat ? En quoi est-il remis en cause par la loi Jardé ? Enfin, quid de l'accident grave de Rennes et du fonctionnement des comités de protection des personnes ?
Premier point, quel est l'esprit initial de la loi Huriet-Sérusclat ? Il s'agit avant tout d'une loi de protection des personnes. Nous nous sommes appuyés sur la déclaration de Nuremberg faisant suite aux expérimentations humaines en camps de concentration. Cette déclaration, qui constituait un choc interpellant la conscience universelle, ne s'était jusque-là pas traduite par une expression législative. Il s'agissait de reconnaître que l'expérimentation était licite mais à la condition absolue que la personne ait donné son consentement, expression même de son indépendance et de sa dignité.
Nous nous sommes également appuyés sur des considérations juridiques, constatant une incompatibilité entre les principes de notre droit et les recommandations européennes. Celles-ci subordonnaient la mise sur le marché d'une nouvelle molécule à des recherches sur le volontaire sain, en contradiction avec le code civil qui pose le principe de l'indisponibilité du corps humain et de l'inviolabilité. En effet, l'indisponibilité, cela signifie que l'on ne peut porter atteinte à l'intégrité physique d'une personne, sauf dans son propre intérêt. Une loi s'imposait, que les pharmacologues-cliniciens appelaient également de leurs voeux, ce qui est assez rare pour être souligné. Cette loi est le premier texte sur les plans européen et international.
Enfin, pour illustrer le contexte médiatique dans lequel intervenait notre proposition de loi, je citerai le travail de deux jeunes journalistes, Aline Richard et Sophie Veyret, Cobayes humains, les secrets de l'expérimentation médicale, qui avaient livré une enquête très sérieuse sur les officines pratiquant des essais sur volontaire sain, avec toutes les aberrations que cela entraîne, y compris sur le plan financier. Les dernières pages de cet ouvrage faisaient état de l'initiative sénatoriale. Les journalistes y voyaient une possible réponse à des situations scandaleuses. Nous n'avons certes pas légiféré sous la pression de l'urgence mais ce paramètre a eu son importance.
La loi Jardé du 5 mars 2012, même s'il vaudrait mieux parler de la loi Lemaire, est née d'une demande des chercheurs, contrairement à la loi Huriet-Sérusclat, qui visait davantage la protection des personnes. C'est au nom des chercheurs académiques qu'est intervenue la « révision de la loi du 20 décembre 1988 : plateforme commune de propositions émanant des sociétés savantes, organismes et associations de malades ». Cette seule précision suffit à faire comprendre qu'il est impossible de rapprocher les deux lois tant leurs points de départ respectifs sont différents.
Les intitulés de ces deux textes traduisent cet état de fait, exemple à l'appui. La loi du 20 décembre 1988 est relative à la protection des personnes qui se prêtent à des recherches biomédicales. La loi du 5 mars 2012 est relative aux recherches impliquant la personne humaine. Or, d'après le Larousse, « impliquer » signifie « attribuer à quelqu'un une part de responsabilité dans une affaire fâcheuse »...
En quoi l'esprit initial de la loi Huriet-Sérusclat se trouve-t-il remis en cause par la loi Jardé ? Ma réponse sera lapidaire : il s'agit d'une autre loi ! En 2012, on a demandé au législateur un texte qui soit bien autre chose que l'amendement de la loi initiale. L'objet de la loi Jardé relative aux recherches impliquant la personne humaine est de simplifier, de faciliter la mise en oeuvre des procédures et de renforcer la sécurité, avec des contraintes graduées en fonction du niveau de risque. C'est d'ailleurs l'un des illogismes de la loi Jardé qui, en soutenant la recherche, vise l'innovation. Or on ignore presque tout de ce qui est nouveau : c'est tout l'objet de l'expérimentation et des essais, dont le but est de réduire la marge d'incertitude sur les bénéfices mais aussi sur les risques ! Bref, quand on classifie les recherches en fonction de leur degré de risque, on n'est pas dans l'innovation...
Par ailleurs, une confusion s'est fait jour entre la recherche et l'étude. Les premiers alinéas du texte initial faisaient référence aux recherches et études. L'Institut national de la santé et de la recherche médicale (Inserm) nous avait alors fait remarquer que le consentement préalable et éclairé d'une personne n'était pas compatible avec certaines études, notamment comportementales. Par exemple, si des personnes sont prévenues des procédures, leurs réactions d'angoisse n'ont plus la même acuité. Il ne faut donc pas confondre la recherche innovante, qui signifie le progrès, avec l'étude. Les comités de protection des personnes (CPP) sont en charge des procédures pour cette deuxième catégorie.
La troisième catégorie est l'évaluation. La recherche d'une nouvelle molécule pour le traitement du cancer n'est évidemment pas la même chose que la mise au point de nouvelles pratiques de soins, y compris pour la protection des personnes. En tout état de cause, l'évaluation est absente de tous les débats. Elle se résume maintenant au tirage au sort des CPP, ce qui est un peu court.
Une des spécificités de la loi Jardé est la transformation des comités de protection des personnes soumises à la recherche biomédicale (CPPRB) en comités de protection des personnes (CPP). Or les CPPRB étaient des structures consultatives. En raison de la diversité de leurs composantes, ils n'étaient pas l'annexe d'une quelconque instance. Par ailleurs, leur compréhension, plus ou moins limitée, des données scientifiques les rapprochait de la société civile. On en a fait des structures de décision, donc de responsabilité, ce qui entraîne comme inconvénient un double pilotage : pour obtenir une autorisation, il faut recueillir à la fois l'avis du CPP et celui de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM).
Sur le fonctionnement des CPPRB, je vous renvoie à mon dernier rapport présenté en avril 2001, qui faisait état d'un certain absentéisme. François Lemaire relevait, lui, la « grande hétérogénéité des pratiques ». Par ailleurs, Mme Geneviève Chêne a également souligné leur méconnaissance des fonctionnements internes.
De nouvelles compétences portant sur la science ont donc été attribuées aux CPP. Quel manque de vision de l'avenir non pas lointain, mais proche ! Imaginez-vous que des gens soient tirés au sort pour se prononcer sur les nanomédicaments ou les stimulations cérébrales ? Alors que leur désignation ne repose pas sur un fondement de compétences scientifiques, comment jugeront-ils du bénéfice et du risque de ces techniques ?
Troisième point, quid de l'accident de Rennes ? Je n'ai pas l'intention d'en parler car tout a été dit. L'essentiel des facteurs ayant entraîné cet accident sont liés à l'élaboration d'une méthodologie et au non-respect de celle-ci. Il aurait fallu s'en tenir à une période de neutralité en attendant d'en savoir plus. Le juge tranchera.
Pour finir, je dirai un mot du tirage au sort. À mon sens, cette initiative repose sur un mouvement de défiance, non pas quant à la compétence des organismes en charge mais à l'égard des conflits d'intérêts. Mais ne perdons pas de vue que le promoteur a besoin que le CPP fasse correctement son travail. Certes, le tirage au sort exclut les conflits d'intérêts mais il ne permet pas de répondre à cette dernière exigence. Le tirage au sort, comme réponse à une méfiance, n'est pas exempt de vices et d'inconvénients.
Par votre insistance, vous avez obtenu un décret confiant, par tirage au sort, un pouvoir de décision à des structures dont les compétences nous sont inconnues. Vous en avez pris connaissance, il faudra le mettre en oeuvre. La création d'un comité national des recherches est une bonne chose. Le rapport d'avril 2001 la suggérait d'ailleurs, avec un statut juridique encore à définir. Pour autant, le tirage au sort me semble très dangereux, tout simplement parce que le comité de protection des personnes n'a jamais été évalué. Les conclusions du rapport d'avril 2001 posaient l'exigence instante d'une évaluation de ces comités pour connaître l'engagement de leurs membres. Or nous n'en savons toujours rien.
Mon analyse est peut-être sévère : protection des personnes dominée par le principe de simplification pour les chercheurs ; confusion entre recherche, innovation et étude ; évaluation des pratiques laissée à un CPP ; décalage entre tirage au sort et évaluation.
En conclusion, cette rencontre constitue pour moi une sorte de réhabilitation. Très rapidement après mon départ du Sénat, des travaux ont été engagés par Marie-Thérèse Hermange et Jean-Pierre Godefroy. Il aurait été convenable, à défaut de pouvoir interroger Franck Sérusclat, de m'auditionner. Par ailleurs, à l'occasion des vingt ans de la loi Huriet-Sérusclat, j'avais émis le souhait qu'un colloque soit organisé par le Sénat. Je n'ai reçu qu'une proposition décevante, faute de moyens financiers, m'a-t-on dit...

Lors des travaux sur la loi Jardé, nous avons essayé de marcher dans vos pas en faisant en sorte de tomber tous d'accord. Je rends hommage à Marie-Thérèse Hermange et à François Autain. Les discussions avec M. Jardé, avec M. Lemaire et avec l'Assemblée nationale ont été extrêmement difficiles. Nous avons mis près d'une année à aboutir à un texte commun, qui ne nous donnait pas complètement satisfaction, mais qui était néanmoins le moins mauvais possible.
Le choix aléatoire des comités de protection de la personne nous tenait à coeur car les promoteurs demandaient à choisir eux-mêmes. Le tirage au sort nous a semblé être une solution. Néanmoins je partage vos craintes pour l'évaluation de ces comités, très disparates sur le territoire.
Le comité national était peut-être une mauvaise idée mais nous voulions une règle qui soit la même pour tous les comités de protection de la personne.
Pour finir, je ne suis pas convaincu que le décret, qui a mis du temps à être publié, soit exactement conforme à nos attentes...
À propos du décret, une analyse critique d'usagers relève que « l'articulation avec le règlement UE n° 536/2014 sur les essais cliniques de médicaments et le futur règlement sur les dispositifs médicaux, pour la partie concernant les investigations cliniques, risque d'être un peu délicate car ces règlements ne prennent pas en compte les recherches non interventionnelles, qui, pour la France, devront passer par la commission RIPH ».
Je suis favorable à une répartition qui ne soit pas laissée au bon vouloir d'un promoteur. Le contexte est international et les recherches pourraient se faire ailleurs. Les différents États membres ont su prendre des dispositions, inspirées de la loi française, pour éviter une fuite vers le moins-disant éthique.
Le tirage au sort n'est une solution que si l'on est assuré au final d'avoir un travail de qualité, y compris pour la protection des personnes. Le rapport de 2001 insistait d'ailleurs sur l'importance de la formation des membres des CPP. La dernière fois que j'ai rencontré M. Jardé, il m'a avoué qu'il souhaitait prévoir une évaluation des instances mais ce que cela lui avait été refusé !

J'ai deux questions, l'une pour l'ancien législateur et l'autre pour le professeur. Premièrement, la ministre de la santé s'est exprimée sur la nécessité de simplifier les procédures et de raccourcir les délais. Cela ne s'accompagnera-t-il pas d'une augmentation du risque ? Deuxièmement, l'Agence européenne du médicament travaille à l'amélioration des protocoles d'essais cliniques par la mise en place d'un nouvel outil. Mais il existe une lacune puisqu'à défaut de réponse dans un délai de deux mois le laboratoire peut considérer que l'essai est accepté. Ne devrait-il pas plutôt considérer que l'essai est refusé ?
C'est une disposition réglementaire. Les instances doivent répondre dans un délai maximum, faute de quoi la non-réponse vaut approbation. Sur le principe, je comprends votre remarque mais comment le législateur pourrait-il contourner un dispositif plus général ?

Vous n'avez pas souhaité vous exprimer sur l'accident de Rennes au motif que tout avait été dit. À ma connaissance, toute la lumière n'a pas été faite sur les événements. Je siège avec certains de mes collègues au conseil d'administration de l'ANSM et j'ai posé des questions. On m'a répondu - est-ce vrai ou faux ? - que le rapport remis par le comité d'experts a été plus ou moins modifié par rapport aux déclarations initiales. L'ANSM a-t-elle joué véritablement son rôle de contrôle ? Si l'on s'en tient aux deux rapports remis par les inspecteurs de l'Igas, il s'agit d'un accident.
Je n'ai pas dit que toute la lumière avait été faite, mais comment en saurais-je plus qu'un administrateur de l'ANSM ? Cette question met en cause la qualité des experts. J'attire votre attention sur l'existence d'exigences inconciliables qui entraînent une pénurie d'experts. Lors des Assises du médicament organisées par Xavier Bertrand, que j'ai présidées, un intervenant, éminent professeur à Paris, avait d'ailleurs soulevé cette difficulté. La contradiction est surtout sensible en ce qui concerne l'innovation et la recherche de pointe. Les firmes pharmaceutiques ou les laboratoires d'État contactent évidemment les scientifiques les plus proches du concept sur lequel ils bâtissent leur projet. L'avis de ces scientifiques, qui sont dès le départ concernés, même s'ils ne sont pas impliqués, est donc entaché de suspicion. Le dilemme paraît grave. Il existe des experts internes mais ils ne sont pas polyvalents. L'accélération de la recherche, des innovations et des découvertes pose en des termes différents des problèmes pour lesquels on pensait avoir des solutions, le tout sur fond de suspicion. On voudrait profiter du progrès sans en subir le risque. C'est pourtant le prix à payer.

Dans une affaire aussi importante que l'accident de Rennes, nous aurions pu faire appel à des experts internationaux, ce qui a été refusé.

Sur le sujet central du choix des experts, quelles sont vos préconisations ? Il me semble que nous devons accepter un certain niveau de risque.
Il faut être intraitable sur la déclaration d'intérêts mais on ne peut pas non plus continuer comme ça car il y a une fuite des experts. Songez qu'ils finissent souvent devant les juges !

Il y a peut-être une fuite mais certains experts internationaux sont nommés alors qu'ils ne disposent pas toujours des compétences nécessaires. Je suis actuellement la question des sels d'aluminium dans les vaccins : un certain nombre d'experts au Japon et en Grande-Bretagne, très à la pointe sur la question, ne sont absolument pas sollicités. Les expertises sont-elles toujours anonymes ? Il me semble important que l'expert puisse assumer son travail. Je suis d'accord avec vous : il faut aller vers plus de transparence. Vous avez évoqué Marie-Thérèse Hermange. Elle est mise en examen dans l'affaire du Mediator, or elle vient d'être nommée au Comité d'éthique de l'Académie de médecine !
Enfin, tout comme M. Barbier, je suis membre du conseil d'administration de l'ANSM. J'ai été troublée par les arguments qui nous ont été donnés : le directeur de l'agence est uniquement chargé de vérifier si le protocole est suivi à la lettre, pas de s'interroger sur sa nature.
Évaluer la pertinence du protocole ne doit pas être une des compétences du directeur de l'agence, qui supporte déjà assez de charges. C'est le rôle des inspections internes et de l'Inspection générale des affaires sociales (Igas).

Je remercie le sénateur Huriet d'avoir répondu favorablement à notre invitation et fourni cet éclairage précieux à la commission.
La réunion est close à midi.